题目内容
11.乙烯和苯是两种基本化工原料,下列有关说法正确的是( )| A. | 乙烯和苯都可以从煤焦油中获得 | |
| B. | 乙烯和苯都是平面结构,因为二者分子中都含有碳碳双键 | |
| C. | 乙烯和苯都能使溴水褪色,且褪色的原因相同 | |
| D. | 乙烯和苯都能与H2发生加成反应 |
分析 A.乙烯不能从煤焦油中获得;
B.苯分子不含碳碳双键;
C.根据苯和乙烯的结构判断其性质;
D.碳碳双键和苯环能发生加成反应.
解答 解:A.从煤焦油中可以获得苯,不能得到乙烯,故A错误;
B.苯分子不含碳碳双键,苯分子中碳碳键是介于双键和单键之间独特的化学键,故B错误;
C.苯不含碳碳双键,所以苯和溴水不发生加成反应;苯是非极性分子,溴是非极性分子,根据相似相溶原理知,溴易溶于苯而使溴水褪色;乙烯含有碳碳双键,能和溴发生加成反应而使溴水褪色,所以两种物质使溴水褪色的原因不同,故C错误;
D.乙烯中含有碳碳双键,其性质较活泼,能发生加成反应;苯环中的键是介于碳碳单键和碳碳双键之间的特殊键,苯也能发生加成反应,故D正确;
故选:D.
点评 本题考查了有机物的性质,注意根据乙烯和苯的结构,据此判断其性质,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
1.NaH与水反应的化学方程式为NaH+H2O═NaOH+H2↑,对该反应叙述中正确的是( )
| A. | 该反应属于置换反应 | |
| B. | NaH中的H为+1价 | |
| C. | 氧化剂是H2O | |
| D. | 每摩尔NaH参加反应时电子转移数为1e- |
2.化学与环境密切相关,下列有关说法正确的是( )
| A. | CO2属于大气污染物 | B. | 酸雨是PH小于7的雨水 | ||
| C. | CO2、NO2或SO2都会导致酸雨的形成 | D. | NO2造成光化学烟雾的主要因素 |
16.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,16 g O3中含有质子总数为8NA | |
| B. | 25℃时,1 mL纯水中含有OH-离子数目为10-10 | |
| C. | pH=2的醋酸稀释10倍后,溶液中H+数目大于0.001NA | |
| D. | 1molCl2与足量NaOH溶液反应,转移的电子数为2NA |
3.锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
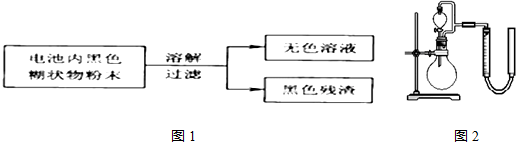
(1)锌锰干电池的电路中每通过0.2mole-,理论上负极质量减少6.5g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑
(2)某研究小组对电池内黑色糊状物进行了下列实验.
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图2所示.将等物质的量浓度、等体积H2O2溶液加入烧瓶中,分别进行2个实验(气体的体积在相同条件下测定).
实验1、2中参加反应的H2O2的物质的量之比为1:1,实验二中反应的离子方程式为H2O2+2H++MnO2═Mn2++2H2O+O2↑.

(1)锌锰干电池的电路中每通过0.2mole-,理论上负极质量减少6.5g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑
(2)某研究小组对电池内黑色糊状物进行了下列实验.
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀,白色沉淀逐渐溶解,产生刺激性气味的气体 | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | MnO2做氧化剂,生成Mn2+离子 |
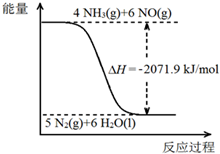 尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.尿素在一定条件下可将氮的氧化物还原为氮气.
尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.尿素在一定条件下可将氮的氧化物还原为氮气.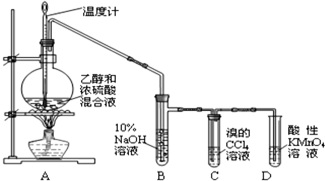
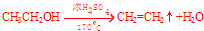 .
.