题目内容
4.下列各组物质,按照化合物、单质、混合物顺序排列的是( )| A. | 干冰、铝粉、漂白粉 | B. | 生石灰、臭氧、熟石灰 | ||
| C. | 烧碱、液态氧、酒精 | D. | 铁红、晶体硅、胆矾 |
分析 由不同种元素组成的纯净物叫做化合物,由一种元素组成的纯净物叫做单质,由两种或两种以上的物质组成的物质是混合物.
解答 解:A.干冰是二氧化碳是化合物,铝粉是单质,漂白粉的主要成分是次氯酸钠和氯化钠,是混合物,故A正确;
B.生石灰和熟石灰是化合物,臭氧是单质,故B错误;
C.烧碱和酒精是化合物,液态氧是单质,故C错误;
D.铁红是氧化铁是化合物,晶体硅是单质,胆矾是化合物,故D错误;
故选A.
点评 本题考查了物质的分类,侧重于纯净物和混合物、单质和化合物的应用,明确各个俗称、别名的化学成分是关键,难度不大.

练习册系列答案
相关题目
12.常温下,下列各组离子在给定溶液中一定能大量共存的是( )
| A. | 含Na2CO3的溶液:K+、Cl-、NO3-、Al3+ | |
| B. | pH=11的溶液:Ba2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Cl-、Ba2+ | |
| D. | 滴加甲基橙试液显红色的溶液:Fe3+、NH4+、Cl-、Br- |
16.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,16 g O3中含有质子总数为8NA | |
| B. | 25℃时,1 mL纯水中含有OH-离子数目为10-10 | |
| C. | pH=2的醋酸稀释10倍后,溶液中H+数目大于0.001NA | |
| D. | 1molCl2与足量NaOH溶液反应,转移的电子数为2NA |
13.下列表述方式错误的是( )
| A. | Fe的基态原子外围电子排布图: | |
| B. | 氯化钠的分子式:NaCl | |
| C. | N的基态原子核外电子排布式:lS22S22p3 | |
| D. | HC10的结构式:H-O-Cl |
5.工业上由焦炭或天然气制氢气的过程中会产生一氧化碳.为了除去氢气中混有的一氧化碳,可在催化剂存在的条件下将一氧化碳与水蒸气发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ•mol-1
该反应在工业上被称为“一氧化碳变换”.
(1)写出该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$.
K(200℃)>K(300℃)(填“>”、“=”或“<”).
(2)恒温恒容条件下,以下能说明该反应达到平衡状态的是a(填字母序号).
a.ν消耗(CO)=ν生成(H2O) b.c(CO2)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
(3)某温度下,在一个容积为10L的密闭容器中加入1mol CO和4mol H2O(g),反应经20min后达到平衡,测得平衡时CO2的物质的量为0.8mol,该时间范围内反应的平均速率ν (CO )=0.004mol•L-1•min-1;平衡常数K的数值为1.
(4)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO 30%、CO210%(均为体积分数).现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,将其中的CO除去.已知不同温度及反应物投料比($\frac{n({H}_{2}O)}{n(CO)}$)下,变换后平衡混合气体中CO的体积分数如下表所示:
①从表中数据可以得到控制不同条件时CO的转化率的变化规律.能使CO的转化率升高,可改变的条件是降低温度、增大反应物投料比(或原料气中水蒸气的比例).
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面.
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ•mol-1
该反应在工业上被称为“一氧化碳变换”.
(1)写出该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$.
K(200℃)>K(300℃)(填“>”、“=”或“<”).
(2)恒温恒容条件下,以下能说明该反应达到平衡状态的是a(填字母序号).
a.ν消耗(CO)=ν生成(H2O) b.c(CO2)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
(3)某温度下,在一个容积为10L的密闭容器中加入1mol CO和4mol H2O(g),反应经20min后达到平衡,测得平衡时CO2的物质的量为0.8mol,该时间范围内反应的平均速率ν (CO )=0.004mol•L-1•min-1;平衡常数K的数值为1.
(4)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO 30%、CO210%(均为体积分数).现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,将其中的CO除去.已知不同温度及反应物投料比($\frac{n({H}_{2}O)}{n(CO)}$)下,变换后平衡混合气体中CO的体积分数如下表所示:
| 投料比 CO的体积分数% 温度/℃ | $\frac{n({H}_{2}O)}{n(CO)}$=1 | $\frac{n({H}_{2}O)}{n(CO)}$=3 | $\frac{n({H}_{2}O)}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面.
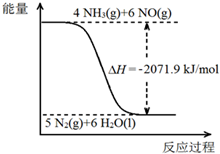 尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.尿素在一定条件下可将氮的氧化物还原为氮气.
尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.尿素在一定条件下可将氮的氧化物还原为氮气.