题目内容
8.一定条件下,将1mol A和3mol B充入恒容密闭容器中,发生如下反应:A(g)+3B(g)?2C(s),下列不能说明该反应已经达到平衡状态的是( )| A. | 气体的密度不再改变 | |
| B. | 混合气体中A的体积分数不再变化 | |
| C. | 混合气体的总压不再变化 | |
| D. | 单位时间内生成a mol A,同时生成2a mol C |
分析 当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断.
解答 解:A、反应前后气体质量减小,容器体积不变,气体密度减小,密度不变说明反应达到平衡状态,故A不选;
B、起始量和反应比相同,反应生成C为固体,所以反应过程中和平衡状态下A体积分数不变,不能说明平衡状态,故B选;
C、反应前后气体体积减小,压强不变,说明反应达到平衡状态,故C不选;
D、单位时间内生成a mol A,同时生成2a mol C,能说明反应正逆反应速率相等,达到平衡状态,故D不选;
故选B.
点评 本题考查化学平衡状态的判断,题目难度不大,注意把握判断的角度以及平衡状态的特征,注意体会

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
16.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,16 g O3中含有质子总数为8NA | |
| B. | 25℃时,1 mL纯水中含有OH-离子数目为10-10 | |
| C. | pH=2的醋酸稀释10倍后,溶液中H+数目大于0.001NA | |
| D. | 1molCl2与足量NaOH溶液反应,转移的电子数为2NA |
3.锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
(1)锌锰干电池的电路中每通过0.2mole-,理论上负极质量减少6.5g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑
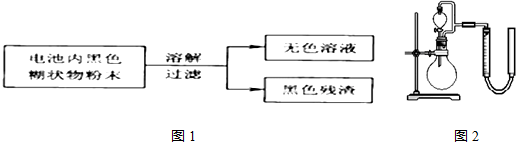
(2)某研究小组对电池内黑色糊状物进行了下列实验.
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图2所示.将等物质的量浓度、等体积H2O2溶液加入烧瓶中,分别进行2个实验(气体的体积在相同条件下测定).
实验1、2中参加反应的H2O2的物质的量之比为1:1,实验二中反应的离子方程式为H2O2+2H++MnO2═Mn2++2H2O+O2↑.

(1)锌锰干电池的电路中每通过0.2mole-,理论上负极质量减少6.5g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑
(2)某研究小组对电池内黑色糊状物进行了下列实验.
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀,白色沉淀逐渐溶解,产生刺激性气味的气体 | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | MnO2做氧化剂,生成Mn2+离子 |
13.下列表述方式错误的是( )
| A. | Fe的基态原子外围电子排布图: | |
| B. | 氯化钠的分子式:NaCl | |
| C. | N的基态原子核外电子排布式:lS22S22p3 | |
| D. | HC10的结构式:H-O-Cl |
17.下列对烃的系统命名正确的是( )
| A. | 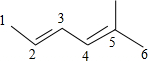 :5-甲基-2,4-己二烯 :5-甲基-2,4-己二烯 | B. |  1,2,3,4-四甲基环己烷 1,2,3,4-四甲基环己烷 | ||
| C. |  :1,3,4-三甲基苯 :1,3,4-三甲基苯 | D. | 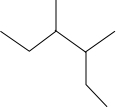 :3-甲基-2-乙基戊烷 :3-甲基-2-乙基戊烷 |
9.化学与生产、生活和社会密切相关.下列说法正确的是( )
| A. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 | |
| B. | 二氧化硫、氮氧化物和可入肺颗粒物是雾霾的主要成分,PM2.5就是指大气中直径小于或等于2.5微米的可入肺颗粒物 | |
| C. | 屠呦呦最早提出用乙醚提取青蒿,其提取物抗疟作用达95%到100%,这种提取原理就是蒸馏,属于物理过程 | |
| D. | 不锈钢具有较强的抗腐蚀性,是因为在钢铁表面镀上了金属铬 |
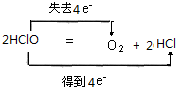 .
.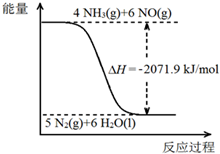 尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.尿素在一定条件下可将氮的氧化物还原为氮气.
尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.尿素在一定条件下可将氮的氧化物还原为氮气.