题目内容
6.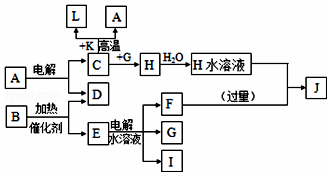 已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图:
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图:请回答:
(1)写出E物质的电子式
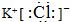
(2)写出C与K反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该反应的反应物总能量大于(填“大于”或“小于”)生成物总能量.
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式2KCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑.
(4)H水溶液中离子浓度由大到小排序c(Cl-)>c(Al3+)>c(H+)>c(OH-)
(5)J与H反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓.
(6)写出G与熟石灰反应制取漂白粉的化学方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
分析 D的元素的原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,则D为O2,K为红棕色固体粉末,应为Fe2O3,由于电解A得到C与D,则C与K生成A的反应为铝热反应,故A为Al2O3,L为Fe,C为Al,黄绿色气体G为Cl2,与C反应得到H为AlCl3,B的焰色反应呈紫色(透过蓝色钴玻璃),含有K元素,B在二氧化锰加热条件下反应生成氧气,则B为KClO3,E为KCl,电解可生成KOH、H2和Cl2,过量的F与氯化铝反应得到J,则I为H2,F为KOH,J为KAlO2,结合对应物质的性质以及题目要求解答该题.
解答 解:D的元素的原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,则D为O2,K为红棕色固体粉末,应为Fe2O3,由于电解A得到C与D,则C与K生成A的反应为铝热反应,故A为Al2O3,L为Fe,C为Al,黄绿色气体G为Cl2,与C反应得到H为AlCl3,B的焰色反应呈紫色(透过蓝色钴玻璃),含有K元素,B在二氧化锰加热条件下反应生成氧气,则B为KClO3,E为KCl,电解可生成KOH、H2和Cl2,过量的F与氯化铝反应得到J,则I为H2,F为KOH,J为KAlO2,
(1)E为KCl,E物质的电子式为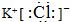 ,故答案为:
,故答案为: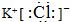 ;
;
(2)C与K反应的化学方程式为:2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该反应为放热反应,故该反应的反应物总能量大于生成物总能量,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;大于;
(3)Fe是目前应用最广泛的金属,用碳棒作阳极,Fe作阴极,接通电源(短时间)电解KCl水溶液的化学方程式为:2KCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑,
故答案为:2KCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑;
(4)H为AlCl3水溶液中铝离子水解溶液先酸性,离子浓度由大到小排序为:c(Cl-)>c(Al3+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(Al3+)>c(H+)>c(OH-);
(5)J与H反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(6)G为Cl2,G与熟石灰反应制取漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
点评 本题考查无机推断等,特殊颜色及D的原子结构、转化关系中特殊反应等是推断突破口,是对元素化合物知识及学生综合能力的考查,需对基础知识全面掌握.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | 原子序数B>A>C | B. | 原子最外层电子数C>A>B | ||
| C. | 原子半径A>C>B | D. | 离子半径A+>B2->C3+ |
| A. | 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 氯化铵溶液与澄清石灰水反应:NH4++OH-?NH3↑+H2O | |
| C. | 碘化亚铁与足量溴水反应:2I-+Br2═I2+2Br- | |
| D. | 氯气溶于水的离子方程式是Cl2+H2O?2H++Cl-+ClO- |
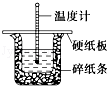 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题: