题目内容
11.将质量比为14:15的N2和NO混和,则混和气体中氮原子和氧原子的个数之比为3:1;该混合气体的平均摩尔质量为29g/mol.分析 N2和NO的质量比为14:15,设N2和NO的总质量分别为28g、30g,根据n=$\frac{m}{M}$计算各自物质的量,计算N原子、O原子物质的量,进而计算N、O原子数目之比,再根据M=$\frac{m}{n}$计算平均摩尔质量.
解答 解:N2和NO的质量比为14:15,设N2和NO的总质量分别为28g、30g,则N2为1mol、NO为1mol,合气体中N2和NO的物质的量之比为1:1,混合气体中氮原子和氧原子的个数比=物质的量之比=(2mol+1mol):1mol=3:1,该混合气体的平均摩尔质量为:$\frac{28g+30g}{1mol+1mol}$=29g/mol,
故答案为:3:1;29g/mol.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系即可解答,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
2.一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A. | 0~60 s,以X的浓度变化表示的反应速率为0.001 mol•L-1•s-1 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
20.已知下述三个实验均能发生化学反应,下列判断正确的是( )
①将铁钉放入硫酸铜溶液中;
②向硫酸亚铁溶液中滴入几滴双氧水;
③将铜丝放入氯化铁溶液中.
①将铁钉放入硫酸铜溶液中;
②向硫酸亚铁溶液中滴入几滴双氧水;
③将铜丝放入氯化铁溶液中.
| A. | 实验①中铁钉做氧化剂 | |
| B. | 实验②中Fe2+具有还原性 | |
| C. | 实验③中发生的是置换反应 | |
| D. | 上述实验证明氧化性Fe3+>Fe2+>Cu2+ |


 ”表示中子.
”表示中子.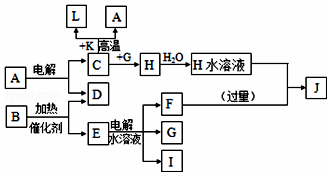 已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图:
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图: