题目内容
18.分析下列物质的物理性质,判断其晶体类型:A.碳化铝,黄色晶体,熔点2 200℃,熔融态不导电原子晶体;
B.溴化铝,无色晶体,熔点98℃,熔融态不导电分子晶体;
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中分子晶体;
D.溴化钾,无色晶体,熔融时或溶于水中都能导电离子晶体.
分析 A.熔点高不是分子晶体的性质;
B.熔沸点较低,液体不导电,则构成微粒为分子;
C.熔沸点较低,易溶于有机溶剂;
D.离子晶体熔融时或溶于水中都能导电.
解答 解:A.碳化铝,黄色晶体,熔点2200℃,熔融态不导电,应为原子晶体,故答案为:原子晶体;
B.溴化铝,无色晶体,熔点98℃,熔融态不导电,具有分子晶体的性质,属于分子晶体,故答案为:分子晶体;
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中,具有分子晶体的性质,属于分子晶体,故答案为:分子晶体;
D.离子晶体熔融时或溶于水中都能导电,故答案为:离子晶体.
点评 本题考查原子晶体、分子晶体、离子晶体的性质,熟悉熔沸点及构成微粒是解答本题的关键,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
3.下列离子方程式中,属于水解反应的是( )
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?HCO3-+H+ | D. | HS-?S2-+H+ |
10.配制下列溶液时常需加入少量括号内的物质,其中不是为了抑制离子水解的是( )
| A. | NaAlO2(NaOH) | B. | SnCl2(HCl) | C. | FeCl3(HCl) | D. | FeSO4(Fe) |
7.有关NaHCO3与Na2CO3的性质,下列叙述中错误的是( )
| A. | Na2CO3和NaHCO3粉末与同浓度盐酸反应,Na2CO3碱性强,反应放出气体速度快 | |
| B. | 等物质的量的两种盐与同浓度的盐酸反应,Na2CO3消耗盐酸的体积是NaHCO3的两倍 | |
| C. | 向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出 | |
| D. | Na2CO3和NaHCO3溶液分别和BaCl2溶液反应,现象不同 |
8.已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O?HCl+HClO达到平衡后,要使HClO浓度增大,可加入( )
| A. | NaCl固体 | B. | 水 | C. | CaCO3固体 | D. | NaOH固体 |
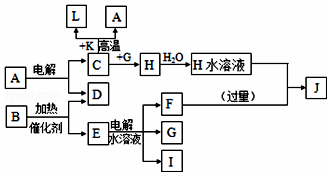 已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图:
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图: