题目内容
下列物质属于弱电解质的是 ( )
| A、氯化钠 | B、蔗糖 |
| C、醋酸 | D、水玻璃 |
考点:强电解质和弱电解质的概念
专题:物质的分类专题
分析:在水溶液中完全电离的电解质为强电解质,在水溶液中部分电离的电解质为弱电解质,可见强弱电解质的根本区别为在溶液中能够完全电离,据此进行解答.
解答:
解:A.氯化钠在水溶液中完全电离,属于强电解质,故A错误;
B.蔗糖不导电,在水溶液中也不导电,蔗糖为非电解质,故B错误;
C.醋酸在水溶液中只能部分电离出醋酸根离子和氢离子,所以醋酸为弱电解质,故C正确;
D.水玻璃为硅酸钠的水溶液,为混合物,不属于电解质,故D错误;
故选C.
B.蔗糖不导电,在水溶液中也不导电,蔗糖为非电解质,故B错误;
C.醋酸在水溶液中只能部分电离出醋酸根离子和氢离子,所以醋酸为弱电解质,故C正确;
D.水玻璃为硅酸钠的水溶液,为混合物,不属于电解质,故D错误;
故选C.
点评:本题考查了电解质与非电解质、强电解质与弱电解质的判断,题目难度不大,注意明确电解质与非电解质、强电解质与弱电解质的概念及区别,明确单质和混合物不属于电解质、非电解质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将一定量的钠铝合金置于水中,合金全部溶解,往溶液中加入1mol/L盐酸20mL,此时沉淀量达到最大值,则原合金中钠的质量为( )
| A、0.46g |
| B、0.02g |
| C、0.80g |
| D、0.23g |
把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A、0.1( b-2a )mol/L |
| B、10( 2a-b )mol/L |
| C、10( b-a )mol/L |
| D、10( b-2a )mol/L |
下列有关说法正确的是( )
| A、棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| B、蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
| C、石英光导纤维,在遇到强碱或强酸时均可以发生“断路” |
| D、黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用非常广泛的金属材料 |
下列有关叙述正确的是( )
| A、高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应 |
| B、实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% |
| C、常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进 |
| D、向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl) |
下列对分子性质的解释中,不正确的是( )
| A、碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
B、由于乳酸(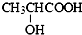 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 |
| C、HF的稳定性很强,是因为其分子间能形成氢键 |
D、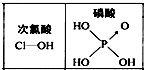 由图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子 |
某化学反应的△H=-122kJ?mol-1,△S=+231J?mol-1?K-1,则此反应在下列哪种情况下可自发进行( )
| A、在任何温度下都能自发进行 |
| B、在任何温度下都不能自发进行 |
| C、仅在高温下自发进行 |
| D、仅在低温下自发进行 |
下列事实不能用勒夏特列原理解释的是( )
| A、在含有Fe(SCN)3的红色溶液中加入3~5滴NaOH稀溶液,振荡静置,混合溶液颜色变浅 |
| B、把盛有NO2(g)、N2O4(g)组成的平衡体系的容器放入到热水中,混合气体的颜色加深 |
| C、反应2NO2(g)═O2(g)+2NO(g)△H<0,达到平衡后,减小压强混合气体颜色变浅 |
| D、使用催化剂可加快SO2转化为SO3的速率 |
将标准状况下a L HCl(g)溶于100g水中,得到的盐酸的密度为b g?cm-3,则该盐酸的物质的量浓度是( )
A、
| ||||
B、
| ||||
C、
| ||||
D、
|