题目内容
下列有关叙述正确的是( )
| A、高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应 |
| B、实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% |
| C、常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进 |
| D、向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl) |
考点:难溶电解质的溶解平衡及沉淀转化的本质,吸热反应和放热反应,化学平衡的计算,水的电离
专题:化学反应中的能量变化,化学平衡专题,电离平衡与溶液的pH专题
分析:A、反应是否吸热与反应条件没有直接的关系;
B、参加反应的物质的物质的量与反应放出的热量成正比;
C、根据氢离子浓度的改变对水的电离平衡移动的影响分析;
D、Ksp(AgCl)>Ksp(AgI).
B、参加反应的物质的物质的量与反应放出的热量成正比;
C、根据氢离子浓度的改变对水的电离平衡移动的影响分析;
D、Ksp(AgCl)>Ksp(AgI).
解答:
解:A、硫酸铵结晶水合物和氢氧化钡的反应在常温下就能进行,但属于吸热反应,有些放热反应需在高温条件下进行,例如铝热反应,故A错误;
B、当放出314.624kJ热量时,反应的二氧化硫的物质的量为
=3.2mol,则SO2的转化率为
80%,故B正确;
C、常温下,向纯水中通入一定量二氧化硫,二氧化硫和水反应生成亚硫酸,溶液呈酸性,会抑制水的电离,故C错误;
D、白色沉淀转化为黄色沉淀,说明生成AgI,生成物溶度积更小,则Ksp(AgCl)>Ksp(AgI),故D错误;
故选B.
B、当放出314.624kJ热量时,反应的二氧化硫的物质的量为
| 314.624KJ |
| 196.64KJ/mol |
| 3.2 |
| 4 |
C、常温下,向纯水中通入一定量二氧化硫,二氧化硫和水反应生成亚硫酸,溶液呈酸性,会抑制水的电离,故C错误;
D、白色沉淀转化为黄色沉淀,说明生成AgI,生成物溶度积更小,则Ksp(AgCl)>Ksp(AgI),故D错误;
故选B.
点评:本题考查较为综合,涉及化学反应与能量,水的电离平衡以及弱电解质的电离等问题,题目难度较大,本题注意D项为易错点,注意解题方法的积累.

练习册系列答案
相关题目
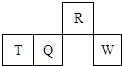 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A、原子半径一定是:T>Q>R |
| B、最高价氧化物对应水化物的酸性一定是:Q<W |
| C、含T的盐溶液一定显酸性 |
| D、最简单气态氢化物的热稳定性一定是:R>Q |
下列物质溶于水时会破坏水的电离平衡,且属于电解质的是( )
| A、氯气 | B、二氧化硫 |
| C、碘化钾 | D、碳酸钠 |
下列物质中,属于电解质的是( )
| A、CO2 |
| B、H2 |
| C、Na2SO4 |
| D、Cu |
下列物质属于弱电解质的是 ( )
| A、氯化钠 | B、蔗糖 |
| C、醋酸 | D、水玻璃 |
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A、反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B、沉淀溶解后,生成深蓝色溶液是由于存在配合离子[Cu(NH3)4]2+ |
| C、向反应后的溶液中加入乙醇,将析出深蓝色的晶体CuSO4?5H2O |
| D、在[Cu(NH3)4]2+离子中,既存在离子键,又存在共价键 |
下列事实与胶体性质无关的是( )
| A、向豆浆中加入盐卤做豆腐 |
| B、长江三角洲、珠江三角洲的形成 |
| C、一束平行光线射入蛋白质溶液里,从侧面可以看到一束光亮的通路 |
| D、向石灰水中通入二氧化碳气体产生白色浑浊 |
