题目内容
把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A、0.1( b-2a )mol/L |
| B、10( 2a-b )mol/L |
| C、10( b-a )mol/L |
| D、10( b-2a )mol/L |
考点:离子方程式的有关计算
专题:
分析:混合溶液分成5等份,每份溶液浓度相同.一份加入含a mol 硫酸钠的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=(Na2SO4);
另一份加入含bmol 硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+),再利用电荷守恒可知每份中2n(Ba2+)+n(K+)=n(Cl-),据此计算每份中n(K+),根据c=
计算钾离子浓度.
另一份加入含bmol 硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+),再利用电荷守恒可知每份中2n(Ba2+)+n(K+)=n(Cl-),据此计算每份中n(K+),根据c=
| n |
| V |
解答:
解:混合溶液分成5等份,每份溶液浓度相同.一份加入含a mol 硫酸钠的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=(Na2SO4)=amol;
另一份加入含bmol 硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+)=bmol,
根据电荷守恒可知每份中2n(Ba2+)+n(K+)=n(Cl-),每份溶液中n(K+)=bmol-2amol=(b-2a)mol,故钾离子浓度为
=10(b-2a) mol?L-1,
故选D.
另一份加入含bmol 硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+)=bmol,
根据电荷守恒可知每份中2n(Ba2+)+n(K+)=n(Cl-),每份溶液中n(K+)=bmol-2amol=(b-2a)mol,故钾离子浓度为
| (b-2a)mol |
| 0.1L |
故选D.
点评:本题考查离子反应的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析、计算能力的考查,注意每份中离子浓度相同,题目难度不大.

练习册系列答案
相关题目
下列关于有机物的说法正确的是( )
| A、乙烯和聚乙烯都能发生加成反应 |
| B、淀粉和纤维素的分子式相同,互为同分异构体 |
| C、粮食酿酒的过程涉及到了水解反应、氧化还原反应等复杂变化 |
| D、向蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液,蛋白质均发生变性 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
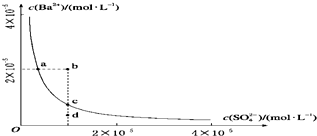

| A、加入Na2SO4可以使溶液由a点变到c点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、b、d点都是不能长时间稳定存在的点 |
| D、a点对应的Ksp大于c点对应的Ksp |
下列物质溶于水时会破坏水的电离平衡,且属于电解质的是( )
| A、氯气 | B、二氧化硫 |
| C、碘化钾 | D、碳酸钠 |
下列物质中,属于电解质的是( )
| A、CO2 |
| B、H2 |
| C、Na2SO4 |
| D、Cu |
下列物质属于弱电解质的是 ( )
| A、氯化钠 | B、蔗糖 |
| C、醋酸 | D、水玻璃 |
为了研究影响化学反应速率的因素,甲、乙、丙、丁四位学生分别设计了如下四个实验,你认为不正确的是( )
| A、在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 |
| B、将相同大小、形状的铝条与稀硫酸和浓硫酸反应时,浓硫酸产生氢气快 |
| C、将氢气和氯气分别放在冷暗处和强光照射下,会发现光照下有氯化氢生成 |
| D、两支试管中分别加入相同条体积的双氧水,其中一支试管合在再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |