题目内容
将一定量的钠铝合金置于水中,合金全部溶解,往溶液中加入1mol/L盐酸20mL,此时沉淀量达到最大值,则原合金中钠的质量为( )
| A、0.46g |
| B、0.02g |
| C、0.80g |
| D、0.23g |
考点:铝的化学性质,化学方程式的有关计算,钠的化学性质
专题:几种重要的金属及其化合物
分析:钠铝合金置于水中,合金全部溶解,发生2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,加盐酸时可能发生NaOH+HCl═NaCl+H2O、NaAlO2+HCl+H2O═NaCl+Al(OH)3↓、Al(OH)3↓+3HCl═AlCl3+3H2O,结合加入20mL盐酸生成的沉淀最多来计算.
解答:
解:由钠铝合金置于水中,合金全部溶解,发生2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,加盐酸时可能发生NaOH+HCl═NaCl+H2O、NaAlO2+HCl+H2O═NaCl+Al(OH)3↓、Al(OH)3↓+3HCl═AlCl3+3H2O可知,
加入1mol/L盐酸20mL,此时沉淀量达到最大值,溶液中的溶质只有NaCl,
则n(Na)=n(NaCl)=n(HCl)=0.02L×1mol/L=0.02mol,其质量为0.02mol×23g/mol=0.46g,
故选A.
加入1mol/L盐酸20mL,此时沉淀量达到最大值,溶液中的溶质只有NaCl,
则n(Na)=n(NaCl)=n(HCl)=0.02L×1mol/L=0.02mol,其质量为0.02mol×23g/mol=0.46g,
故选A.
点评:本题考查Al的化学性质及计算,为高频考点,把握发生的反应及原子守恒为解答的关键,注意判断沉淀最多时溶质为NaCl即可解答,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
下列关于有机物的说法正确的是( )
| A、乙烯和聚乙烯都能发生加成反应 |
| B、淀粉和纤维素的分子式相同,互为同分异构体 |
| C、粮食酿酒的过程涉及到了水解反应、氧化还原反应等复杂变化 |
| D、向蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液,蛋白质均发生变性 |
对如图所示分子的描述不正确的是( )
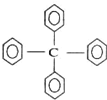

| A、该物质的分子式为C25H20 |
| B、该物质所有氢原子不可能在同一平面上 |
| C、该物质属于烷烃 |
| D、该物质的一氯代物有3种 |
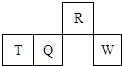 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A、原子半径一定是:T>Q>R |
| B、最高价氧化物对应水化物的酸性一定是:Q<W |
| C、含T的盐溶液一定显酸性 |
| D、最简单气态氢化物的热稳定性一定是:R>Q |
在污染环境的有害气体中,主要由于跟血红蛋白结合而引起中毒的有毒气体是( )
| A、SO2 |
| B、CO2 |
| C、NO2 |
| D、CO |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
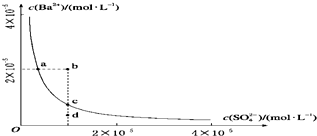

| A、加入Na2SO4可以使溶液由a点变到c点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、b、d点都是不能长时间稳定存在的点 |
| D、a点对应的Ksp大于c点对应的Ksp |
下列物质属于弱电解质的是 ( )
| A、氯化钠 | B、蔗糖 |
| C、醋酸 | D、水玻璃 |