题目内容
将标准状况下a L HCl(g)溶于100g水中,得到的盐酸的密度为b g?cm-3,则该盐酸的物质的量浓度是( )
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:根据n=
计算出标况下aL氯化氢的物质的量,再根据m=nM计算出该氯化氢的质量,从而得出溶液的质量及溶质的质量分数,然后根据物质的量浓度与溶质质量分数的表达式c=
计算出该溶液的物质的量浓度.
| V |
| Vm |
| 1000ρw |
| M |
解答:
解:标准状况下,aLHCl的物质的量为:n(HCl)=
=
mol,
该氯化氢的物质的量为:m(HCl)=36.5g/mol×
mol=
g,
该溶液的质量为:100g+
g,
则该溶液中溶质的质量分数为:
=
,
该溶液的物质的量浓度为:c(HCl)=
=
mol/L=
mol/L,
故选D.
| aL |
| 22.4L/mol |
| a |
| 22.4 |
该氯化氢的物质的量为:m(HCl)=36.5g/mol×
| a |
| 22.4 |
| 36.5a |
| 22.4 |
该溶液的质量为:100g+
| 36.5a |
| 22.4 |
则该溶液中溶质的质量分数为:
| ||
100g+
|
| 36.5a |
| 2240+36.5a |
该溶液的物质的量浓度为:c(HCl)=
| 1000ρw |
| M |
1000×
| ||
| 36.5 |
| 1000ab |
| 36.5a+2240 |
故选D.
点评:本题考查了物质的量浓度的计算,题目难度中等,通过字母的计算加大了计算难度,需要熟练掌握物质的量浓度、溶质质量分数的概念及转化关系,计算溶液体积时,不能简单用水与氯化氢的体积加和当作溶液体积,为易错点.

练习册系列答案
相关题目
下列物质属于弱电解质的是 ( )
| A、氯化钠 | B、蔗糖 |
| C、醋酸 | D、水玻璃 |
为了研究影响化学反应速率的因素,甲、乙、丙、丁四位学生分别设计了如下四个实验,你认为不正确的是( )
| A、在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 |
| B、将相同大小、形状的铝条与稀硫酸和浓硫酸反应时,浓硫酸产生氢气快 |
| C、将氢气和氯气分别放在冷暗处和强光照射下,会发现光照下有氯化氢生成 |
| D、两支试管中分别加入相同条体积的双氧水,其中一支试管合在再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
下列事实与胶体性质无关的是( )
| A、向豆浆中加入盐卤做豆腐 |
| B、长江三角洲、珠江三角洲的形成 |
| C、一束平行光线射入蛋白质溶液里,从侧面可以看到一束光亮的通路 |
| D、向石灰水中通入二氧化碳气体产生白色浑浊 |
下列说法中正确的是( )
| A、32gO3所含有的原子数目与1molO2所含原子物质的量相等 |
| B、4g金属钙变成钙离子时失去的电子数目为0.1NA |
| C、1molCH3+所含的电子数为10NA |
| D、标准状况下,22.4L H2O所含的分子数为NA |
分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法.下列关于“Na2SO3”的分类不正确的是( )
| A、强酸盐 | B、强碱盐 |
| C、电解质 | D、正盐 |
下列示意图与对应的反应情况符合的是( )
A、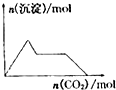 向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量 |
B、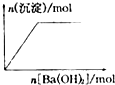 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量 |
C、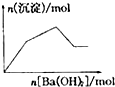 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量 |
D、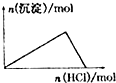 向NaAlO2溶液中逐滴加入盐酸至过量 |
