题目内容
3.将一定量铜与足量浓硝酸充分反应,可以得到6.72L NO2气体(气体体积在标准状况下测定).(1)反应中被还原的硝酸的物质的量为0.3mol
(2)参加反应的铜的质量为9.6g
(3)若改用排水法收集气体,则可收集到气体的体积(标准状况下)为2.24L.
分析 (1)发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,被还原的硝酸转化为二氧化氮,根据N原子守恒计算被还原硝酸的物质的量;
(2)根据方程式计算参加反应Cu的物质的量,再根据m=nM计算其质量;
(3)用排水法收集气体,发生反应:3NO2+H2O=2HNO3+NO,收集的气体为NO.
解答 解:(1)发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应生成二氧化氮的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,被还原的硝酸转化为二氧化氮,根据N原子守恒,被还原硝酸的物质的量为0.3mol,
故答案为:0.3mol;
(2)根据方程式可知,参加反应Cu的物质的量为0.3mol×$\frac{1}{2}$=0.15mol,则参加反应的Cu的质量为0.15mol×64g/mol=9.6g,
故答案为:9.6g;
(3)用排水法收集气体,发生反应:3NO2+H2O=2HNO3+NO,收集的气体为NO,体积为6.72L×$\frac{1}{3}$=2.24L,
故答案为:2.24L.
点评 本题考查化学方程式计算、氧化还原反应计算,注意根据化合价变化理解氧化还原反应基本概念,比较基础.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
13.下列叙述中正确的是( )
| A. | 在元素周期表中除短周期外,其他周期均有18种元素 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 副族元素中没有非金属元素 | |
| D. | 碱金属元素是指IA族的所有元素 |
14.只需加入一种试剂就可以把Na2SiO3、Na2CO3、MgCl2、Ba(HCO3)2四种无色溶液鉴别出来,这种试剂是( )
| A. | 盐酸 | B. | 硫酸 | C. | 石灰水 | D. | 硝酸银溶液 |
11.空气是人类生存所必需的重要资源.2015年2月28日,知名媒体人柴静向多家视频网站免费奉献了大型空气污染深度公益调查-《柴静雾霾调查:穹顶之下》,唤起了新一轮关注环保的热情.下列措施不利于环保的是( )
| A. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| B. | 实施绿化工程,防治扬尘污染 | |
| C. | 研制开发燃料电池汽车,消除机动车尾气污染 | |
| D. | 加大石油、煤炭的开采速度,增加化石燃料的供应量 |
18.在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中氧化剂与还原剂物质的量之比为( )
| A. | 1:8 | B. | 8:1 | C. | 1:5 | D. | 5:1 |
8.25℃时,在浓度为1mol•L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得c(NH4+)分别为a、b、c(单位为mol•L-1).下列判断正确的是( )
| A. | a=b=c | B. | a>b>c | C. | a>c>b | D. | c>a>b |
12.下列说法正确的是( )
| A. | 增加反应物的用量一定能增大反应速率 | |
| B. | 化学反应速率只能加快不能减慢 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 参加反应物质的性质是决定化学反应速率的主要因素 |
13.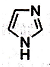 离子液体在有机合成、无机合成等方面有着重要应用.咪唑是合成“离子液体”的一种原料,其结构如图所示.下列有关咪唑说法不正确的是( )
离子液体在有机合成、无机合成等方面有着重要应用.咪唑是合成“离子液体”的一种原料,其结构如图所示.下列有关咪唑说法不正确的是( )
 离子液体在有机合成、无机合成等方面有着重要应用.咪唑是合成“离子液体”的一种原料,其结构如图所示.下列有关咪唑说法不正确的是( )
离子液体在有机合成、无机合成等方面有着重要应用.咪唑是合成“离子液体”的一种原料,其结构如图所示.下列有关咪唑说法不正确的是( )| A. | 化学式C3H4N2 | |
| B. | 分子中含有一种非极性键和两种极性键 | |
| C. | 可以发生取代、加成、氧化反应 | |
| D. | 一氯取代物的同分异构体共有4种 |
 .
.