题目内容
常温下,关于下列各溶液的叙述不正确的是( )
| A、pH=7的醋酸钠和醋酸的混合溶液中,c(Na+)=c(CH3COO-) |
| B、O.1mol?L-1的醋酸的pH=a,0.01mol?L-1的醋酸的pH=b,则a+1>b>a |
| C、20mL0.1mol?L-1醋酸钠溶液与10mL0.1mol?L-1盐酸混合后溶液显酸性,则c(H+)+c(Na+)=c(CH3COO-)+c(Cl-) |
| D、已知酸性:HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中,[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.pH=7的溶液中氢离子与氢氧根离子浓度相等,根据电荷守恒可知c(Na+)=c(CH3COO-);
B.醋酸为弱酸,浓度越大电离程度越小,据此判断两溶液的氢离子浓度及pH大小;
C.混合液一定满足电荷守恒,根据电荷守恒判断;
D.NaF溶液与CH3COOK溶液都显示碱性,pH相等时溶液中氢离子、氢氧根离子浓度相等,根据电荷守恒可得:[c(Na+)-c(F-)]=c(OH-)-c(H+)=[c(K+)-c(CH3COO-)].
B.醋酸为弱酸,浓度越大电离程度越小,据此判断两溶液的氢离子浓度及pH大小;
C.混合液一定满足电荷守恒,根据电荷守恒判断;
D.NaF溶液与CH3COOK溶液都显示碱性,pH相等时溶液中氢离子、氢氧根离子浓度相等,根据电荷守恒可得:[c(Na+)-c(F-)]=c(OH-)-c(H+)=[c(K+)-c(CH3COO-)].
解答:
解:A.pH=7的醋酸钠和醋酸的混合溶液为中性溶液,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-),故A正确;
B.O.1mol?L-1的醋酸的pH=a,0.01mol?L-1的醋酸的pH=b,醋酸浓度越大,电离程度越小,则pH=0.1mol/L的醋酸溶液中氢离子浓度小于浓度为0.01mol/L氢离子浓度的10倍,两溶液的pH之差小于1,即:a+1>b、b>a,则:a+1>b>a,故B正确;
C.20mL0.1mol?L-1醋酸钠溶液与10mL0.1mol?L-1盐酸混合后溶液显酸性,根据电荷守恒可得:c(H+)+c(Na+)=c(CH3COO-)+c(Cl-),故C正确;
D.NaF溶液与CH3COOK溶液都显示碱性,pH相等时溶液中氢离子、氢氧根离子浓度相等,根据电荷守恒可得:[c(Na+)-c(F-)]=c(OH-)-c(H+)、c(OH-)-c(H+)=[c(K+)-c(CH3COO-)],所以,[c(Na+)-c(F-)]=[c(K+)-c(CH3COO-)],故D错误;
故选D.
B.O.1mol?L-1的醋酸的pH=a,0.01mol?L-1的醋酸的pH=b,醋酸浓度越大,电离程度越小,则pH=0.1mol/L的醋酸溶液中氢离子浓度小于浓度为0.01mol/L氢离子浓度的10倍,两溶液的pH之差小于1,即:a+1>b、b>a,则:a+1>b>a,故B正确;
C.20mL0.1mol?L-1醋酸钠溶液与10mL0.1mol?L-1盐酸混合后溶液显酸性,根据电荷守恒可得:c(H+)+c(Na+)=c(CH3COO-)+c(Cl-),故C正确;
D.NaF溶液与CH3COOK溶液都显示碱性,pH相等时溶液中氢离子、氢氧根离子浓度相等,根据电荷守恒可得:[c(Na+)-c(F-)]=c(OH-)-c(H+)、c(OH-)-c(H+)=[c(K+)-c(CH3COO-)],所以,[c(Na+)-c(F-)]=[c(K+)-c(CH3COO-)],故D错误;
故选D.
点评:本题考查了溶液中离子浓度大小比较、电离平衡的影响因素,题目难度中等,注意正确把握电荷守恒、物料守恒的含义,明确弱电解质的电离平衡及其影响,能够根据电荷守恒、物料守恒、盐的水解判断溶液中各离子浓度大小.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
Mg、Cu和Al三种金属粉末的混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量NaOH溶液,再过滤,滤液中存在的离子有( )
| A、AlO2- |
| B、Al3+ |
| C、Mg2+ |
| D、Cu2+ |
下列推断正确的是( )
| A、金属单质与盐溶液的反应都是置换反应 |
| B、SO2和CO2都是酸性氧化物,都能与NaOH溶液反应 |
| C、Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同 |
| D、C、N、S三种单质直接与O2反应都能生成两种以上氧化物 |
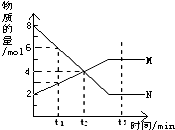 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:2N?M |
| B、Bt2时,正逆反应速率相等,达到平衡 |
| C、t1时,N的浓度是M的浓度的2倍 |
| D、t3时,正反应速率大于逆反应速率 |
常温下,下列电解质溶液的有关叙述正确的是( )
| A、新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| C、pH═11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| D、同浓度同体积的强酸与强碱溶液混合后,溶液的pH=7 |
25℃时,向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是( )
| A、AgCl的溶解度增大 |
| B、AgCl的溶解度、Ksp均不变 |
| C、Ksp(AgCl)增大 |
| D、AgCl的溶解度、Ksp均增大 |
利用反应:2NO(g)+2CO?2CO2(g)+N2(g)△H=-746.8KJ?mol-1可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
| A、降低温度 |
| B、增大压强 |
| C、升高温度同时充入N2 |
| D、用时将CO2和N2从反应体系中移走 |
 CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是