题目内容
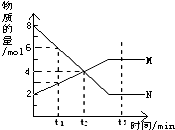 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:2N?M |
| B、Bt2时,正逆反应速率相等,达到平衡 |
| C、t1时,N的浓度是M的浓度的2倍 |
| D、t3时,正反应速率大于逆反应速率 |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:达到平衡时,N的物质的量为2mol,变化6mol,M的物质的量为5mol,变化3mol,反应的方程式为2N?M,结合图象解答该题.
解答:
解:A.达到平衡时,N的物质的量为2mol,变化6mol,M的物质的量为5mol,变化3mol,反应的方程式为2N?M,故A正确;
B.t2时,没有达到平衡状态,则正逆反应速率不等,故B错误;
C.t1时,N的物质的量为6mol,M的物质的量为3mol,则N的浓度是M浓度的2倍,故C正确;
D.t3时,达到平衡状态,则正逆反应速率相等,故D错误;
故选AC.
B.t2时,没有达到平衡状态,则正逆反应速率不等,故B错误;
C.t1时,N的物质的量为6mol,M的物质的量为3mol,则N的浓度是M浓度的2倍,故C正确;
D.t3时,达到平衡状态,则正逆反应速率相等,故D错误;
故选AC.
点评:本题考查化学平衡与图象问题的考查,侧重于学生的分析能力的考查,为高考常见题型,难度中等,注意把握图象曲线变化的趋势以及平衡状态的判断.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
下列说法正确的是( )
| A、乙烯的结构简式为CH2CH2 |
| B、聚乙烯的单体为-CH2-CH2- |
| C、除去乙烷中的乙烯,常用酸性高锰酸钾溶液 |
| D、用水可以鉴别苯、乙醇、溴苯 |
下列各种说法正确的是( )
| A、强碱性溶液中:K+、Al3+、HCO3-、SO42-能大量共存 |
| B、室温下,pH=0的溶液中:Na+、Fe3+、NO3-、SO42-能大量共存 |
| C、0.1mol?L-1 Na2S溶液在中:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| D、0.1mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
下列实验装置图符合实验要求的是( )
A、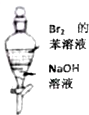 用NaOH溶液除去苯中少量的Br2 |
B、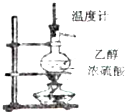 实验室用乙醇和浓硫酸制备乙烯 |
C、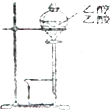 除去乙醇中少量的乙酸 |
D、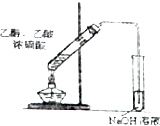 实验室制备并收集乙酸乙酯 |
在水电离出的c(H+)=1×10-12mol/L条件下,下列各组离子一定不能大量共存的是( )
| A、NH4+、NO3-、Cl-、Na+ |
| B、K+、SO32-、Cl-、NO3- |
| C、Na+、SO42-、Cl-、HCO3- |
| D、Na+、NO3-、K+、SO32- |
常温下,关于下列各溶液的叙述不正确的是( )
| A、pH=7的醋酸钠和醋酸的混合溶液中,c(Na+)=c(CH3COO-) |
| B、O.1mol?L-1的醋酸的pH=a,0.01mol?L-1的醋酸的pH=b,则a+1>b>a |
| C、20mL0.1mol?L-1醋酸钠溶液与10mL0.1mol?L-1盐酸混合后溶液显酸性,则c(H+)+c(Na+)=c(CH3COO-)+c(Cl-) |
| D、已知酸性:HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中,[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
| A、10mL 1mol/HCN恰好与10mL 1mol/LNaOH溶液完全反应 |
| B、1mol/L HCN溶液的pH约为3 |
| C、在相同条件下,HCN溶液的导电性比强酸溶液的弱 |
| D、HCN易溶于水 |
下列物质中属于强电解质的是( )
| A、H2O |
| B、H2SO3 |
| C、铜 |
| D、NH4Cl |