题目内容
14. 甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )| A. | 若戊为一种强碱且焰色反应为黄色,则上述反应可能都属于氧化还原反应 | |
| B. | 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙一定是铜和稀硝酸 | |
| C. | 若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲 | |
| D. | 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色 |
分析 A、若戊为一种强碱且焰色反应为黄色,则戊为氢氧化钠,根据转化关系,甲乙分别为钠和氧气,丙可以是氧化钠或过氧化钠,据此分析;
B、常温下,若丙为无色气体,戊为红棕色气体应为二氧化氮,则丙为一氧化氮,所以甲、乙可以是铜和稀硝酸反应生成一氧化氮也可以是其它金属和稀硝酸的反应生成NO;
C、若甲为硫磺燃烧产物即为二氧化硫,则丙为三氧化硫,丁为水,戊为硫酸;
D、若甲为浓盐酸,乙为MnO2,则丙为氯气,若丁为水,则戊为次氯酸,据此分析;
解答 解:A、若戊为一种强碱且焰色反应为黄色,则戊为氢氧化钠,根据转化关系,甲乙分别为钠和氧气,丙可以是氧化钠或过氧化钠,若丙为过氧化钠,则上述反应可能都属于氧化还原反应,故A正确;
B、常温下,若丙为无色气体,戊为红棕色气体应为二氧化氮,则丙为一氧化氮,所以甲、乙可以是铜和稀硝酸反应生成一氧化氮也可以是其它金属和稀硝酸的反应生成NO,故B错误;
C、若甲为硫磺燃烧产物即为二氧化硫,则丙为三氧化硫,丁为水,戊为硫酸,浓硫酸可干燥二氧化硫,故C正确;
D、若甲为浓盐酸,乙为MnO2,则丙为氯气,若丁为水,则戊为次氯酸,次氯酸能使品红褪色,故D正确,
故选B.
点评 本题考查无机物的推断,熟悉物质的性质及转化关系图中的反应是解答本题的关键,题目难度中等,注意稀硝酸生成一氧化氮,可以和铜反应,也可以是和其它金属反应,这是本题的易错点.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
4.加入HCl溶液后,溶液中离子数目会减少的是( )
| A. | CO32- | B. | Al3+ | C. | SO42- | D. | NO3- |
5.铅蓄电池的总反应为:PbO2(s)+Pb(s)+2H2SO4(aq) $?_{充电}^{放电}$ 2PbSO4(s)+2H2O(l)关于铅蓄电池的说法正确的是( )
| A. | 在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-═PbSO4(s) | |
| B. | 在放电时,该电池的负极材料是铅板 | |
| C. | 在充电时,电池中硫酸的浓度不断变小 | |
| D. | 在充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
19.下列做法对人体健康不会造成危害的是( )
| A. | 用工业盐(NaNO2)作咸味调味品 | |
| B. | 用硫磺熏制银耳,使它颜色更白 | |
| C. | 食盐中加入一定量的碘酸钾(KIO3)制取加碘食盐 | |
| D. | 将含有甲醇(CH3OH)的工业酒精兑制成饮用白酒 |
6.下列物质中,属于电解质的是( )
| A. | H2 | B. | AlCl3 | C. | CH4 | D. | H2SO4 |
12.发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃刹.
(1)已知:2N2H4(1)+N2O4(1)═3N2(g)+4H2O(1)△H=-1225kJ•mol-1
断开1mol下列化学键吸收的能量分别为:N-H:391kJ;N-N:193kJ;N≡N:946kJ;O-H:463kJ.
则使1molN2O4(1)分子中化学键完全断裂时需要吸收的能量是1803KJ.
(2)t℃时,将一定量的NO2(g)和N2O4(g)充入一个容积为2L的恒容密闭容器中,浓度随时间变化关系如表所示:
①c(X)代表NO2(填化学式)的浓度,该反应的平衡常数K=0.9;
②前10min内用NO2表示的反应速率为0.04mol/(L•min),20min时改变的条件是增大NO2的浓度(或向容器中加入0.8mol二氧化氮);重新达到平衡时,NO2的百分含量与原平衡状态相比B(填序号)
A.增大 B.减小 C.不变 D.无法判断
(3)肼的性质与氨相似,其水溶液显弱碱性.请用电离方程式表示肼的水溶液显碱性的原因:N2H4+H2O?N2H+5+OH-.肼与氧气构成的燃料电池在碱性条件下放电时,生成水与一种无污染的气体.放电时,该电池负极的电极反应式为N2H4+4OH--4e-=4H2O+N2.
(4)已知在相同条件下N2H4•H2O的电离程度大于N2H5Cl的水解程度.常温下,若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(1)已知:2N2H4(1)+N2O4(1)═3N2(g)+4H2O(1)△H=-1225kJ•mol-1
断开1mol下列化学键吸收的能量分别为:N-H:391kJ;N-N:193kJ;N≡N:946kJ;O-H:463kJ.
则使1molN2O4(1)分子中化学键完全断裂时需要吸收的能量是1803KJ.
(2)t℃时,将一定量的NO2(g)和N2O4(g)充入一个容积为2L的恒容密闭容器中,浓度随时间变化关系如表所示:
| 时间 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol•L-1 | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol•L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②前10min内用NO2表示的反应速率为0.04mol/(L•min),20min时改变的条件是增大NO2的浓度(或向容器中加入0.8mol二氧化氮);重新达到平衡时,NO2的百分含量与原平衡状态相比B(填序号)
A.增大 B.减小 C.不变 D.无法判断
(3)肼的性质与氨相似,其水溶液显弱碱性.请用电离方程式表示肼的水溶液显碱性的原因:N2H4+H2O?N2H+5+OH-.肼与氧气构成的燃料电池在碱性条件下放电时,生成水与一种无污染的气体.放电时,该电池负极的电极反应式为N2H4+4OH--4e-=4H2O+N2.
(4)已知在相同条件下N2H4•H2O的电离程度大于N2H5Cl的水解程度.常温下,若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
13.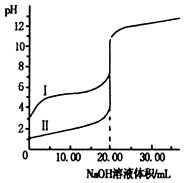 室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )
室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )
 室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )
室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )| A. | I、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | V(NaOH)=10.00mL时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$>1 | |
| C. | pH=7时,两种酸所消耗NaOH溶液的体积相等 | |
| D. | V(NaOH)=20.00mL时,c(Cl一)<c(CH3COO一) |