题目内容
升高温度对CH3COOH的电离平衡、FeCl3的水解平衡、AgCl的溶解平衡的影响分别是( )
| A、促进、促进、促进 |
| B、抑制、抑制、促进 |
| C、促进、抑制、抑制 |
| D、抑制、促进、抑制 |
考点:弱电解质在水溶液中的电离平衡,影响盐类水解程度的主要因素,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:CH3COOH的电离平衡、FeCl3的水解平衡、AgCl的溶解平衡都是吸热反应,所以的动态平衡都符合平衡移动的原理.
解答:
解:升高温度平衡向吸热反应方向移动,所以升高温度对CH3COOH的电离平衡、FeCl3的水解平衡、AgCl的溶解平衡都起促进作用,故答案为:A.
点评:本题考查了弱电解质的电离、盐的水解、难溶物的溶解,明确弱电影响因素是解本题关键,题目难度不大.

练习册系列答案
相关题目
由Zn、Fe、Mg、Al四种金属中的两种组成的混合物10g与足量的盐酸反应产生1.0g H2,则混合物中一定含有的金属是( )
| A、Zn | B、Fe | C、Al | D、Mg |
常温时,①pH=2的CH3COOH溶液; ②pH=2的HCl溶液; ③pH=12的氨水;④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中,不正确的是( )
| A、由水电离的c(H+):①=②=③=④ |
| B、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| C、将②、③溶液混合后,若pH=7,则消耗溶液的体积:②>③ |
| D、四种溶液均稀释100倍后,溶液的pH:③>④>②>① |
一个真空恒容密闭容器中盛有2mol PCl5,加热到200℃发生了反应PCl5(g)?PCl3(g)+Cl2(g),
反应达到平衡时PCl5的分解率为a%.若在同一温度下和同样容器中最初投入的是1mol PCl5,反应达到平衡时PCl5的分解率为b%,a与b的关系是( )
反应达到平衡时PCl5的分解率为a%.若在同一温度下和同样容器中最初投入的是1mol PCl5,反应达到平衡时PCl5的分解率为b%,a与b的关系是( )
| A、a>b | B、a<b |
| C、a=b | D、不能确定 |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A、工业上利用元素A的单质冶炼金属铁 |
| B、元素C是自然界含量最多的金属元素 |
| C、工业上常用电解法制备元素C、D、E的单质 |
| D、化合物AE与CE有相同类型的化学键 |
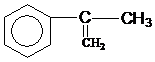 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: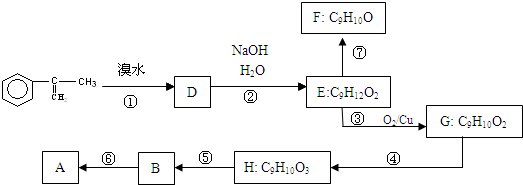
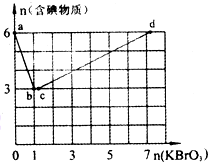 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加人KBrO3的物质的量的关系如图所示.请回答下列问题:
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加人KBrO3的物质的量的关系如图所示.请回答下列问题: