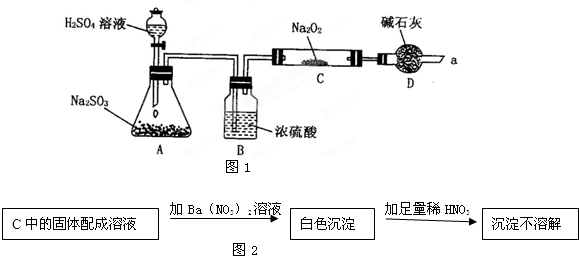
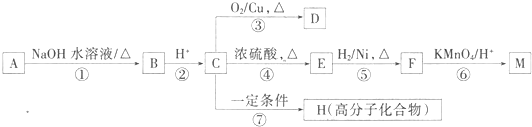
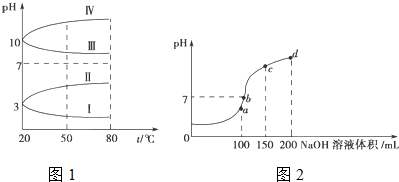
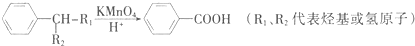题目内容
由Zn、Fe、Mg、Al四种金属中的两种组成的混合物10g与足量的盐酸反应产生1.0g H2,则混合物中一定含有的金属是( )
| A、Zn | B、Fe | C、Al | D、Mg |
考点:有关混合物反应的计算
专题:
分析:根据n=
计算出氢气的物质的量,假设假设都是+2价,则混合金属的物质的量与氢气的物质的量相等,然后根据M=
计算出混合金属的平均摩尔质量,最后根据金属的摩尔质量进行判断,注意Al为+2价时的摩尔质量为:
×2=18g/mol.
| m |
| M |
| m |
| n |
| 27g/mol |
| 3 |
解答:
解:1.0g氢气的物质的量为:n(H2)=
=0.5mol,
假设金属都为+2价金属,则混合金属的平均摩尔质量为:M=
=20g/mol,
Zn的摩尔质量为:65g/mol>20g/mol,
Fe的摩尔质量为:56g/mol>20g/mol,
Mg的摩尔质量为:24g/mol>20g/mol,
Al为+2价时的摩尔质量为:
×2=18g/mol<20g/mol,
根据以上分析可知,混合金属中一定含有铝元素,才能满足平均摩尔质量=20g/mol,所以C正确,
故选C.
| 1.0g |
| 2g/mol |
假设金属都为+2价金属,则混合金属的平均摩尔质量为:M=
| 10g |
| 0.5mol |
Zn的摩尔质量为:65g/mol>20g/mol,
Fe的摩尔质量为:56g/mol>20g/mol,
Mg的摩尔质量为:24g/mol>20g/mol,
Al为+2价时的摩尔质量为:
| 27g/mol |
| 3 |
根据以上分析可知,混合金属中一定含有铝元素,才能满足平均摩尔质量=20g/mol,所以C正确,
故选C.
点评:本题考查了混合金属与酸反应的化学计算,题目难度中等,注意掌握平均摩尔质量在化学计算中的应用方法,试题考查学生酸性的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
镁、铝、锌、铁四种金属共20g,使其与稀硫酸恰好完全反应,将反应后所得溶液蒸干,得固体116g,则反应过程中产生气体的体积在标准状况下约为( )
| A、44.8L | B、33.6L |
| C、22.4L | D、无法确定 |
欲配制100mL1.0mol/LNa2CO3溶液,正确的方法是( )
| A、将10.6gNa2CO3溶于100mL水中 |
| B、将28.6g Na2CO3?10H2O溶于少量水中,再用水稀释至100mL |
| C、将20mL5.0mol/L Na2CO3溶液用水稀释至100mL |
| D、在20mL5.0mol/L Na2CO3溶液中加入80mL水 |
步行街口的烧烤摊常常买一些腌制类食品如:火腿、香肠等,其实在这里面一般都加了防腐剂,指( )
| A、苯甲酸钠 | B、亚硝酸钠 |
| C、味精 | D、胭脂红 |
升高温度对CH3COOH的电离平衡、FeCl3的水解平衡、AgCl的溶解平衡的影响分别是( )
| A、促进、促进、促进 |
| B、抑制、抑制、促进 |
| C、促进、抑制、抑制 |
| D、抑制、促进、抑制 |