题目内容
9.下列分子的空间构型可用sp2杂化轨道来解释的是( )①BF3 ②CH2═CH2 ③
 ④CH≡CH ⑤NH3 ⑥CH4.
④CH≡CH ⑤NH3 ⑥CH4.| A. | ①②③ | B. | ①⑤⑥ | C. | ②③④ | D. | ③⑤⑥ |
分析 根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.可用sp2杂化轨道来解释说明中心原子含有3个价层电子对,据此分析判断.
解答 解:①BF3分子中价层电子对个数=3+$\frac{1}{2}$(3-3×1)=3,中心原子杂化类型分别为sp2,故①正确;
②CH2═CH2 分子中碳原子价层电子对个数=3+$\frac{1}{2}$(4-4×1)=3,每个碳原子杂化轨道数为3,所以采取sp2杂化,故②正确;
③苯分子中碳原子价层电子对个数=3+$\frac{1}{2}$(4-4×1)=3,杂化轨道数为3,所以采取sp2杂化,故③正确;
④CH≡CH分子中每个碳原子形成1个C-H,1个C≡C三键,碳原子价层电子对个数=2+$\frac{1}{2}$(4-4×1)=2,每个碳原子杂化轨道数为2,所以采取sp杂化,故④错误;
⑤NH3中N原子杂化轨道数为$\frac{1}{2}$(5+3)=4,采取sp3杂化方式,故⑤错误;
⑥CH4中碳原子价层电子对个数=4+0=4,为sp3杂化,故⑥错误;
故选A.
点评 本题考查了原子杂化类型的判断,难度不大,根据“杂化轨道数=δ键数+孤对电子对数”来解答即可,原子杂化类型的判断是高考的热点,所以是学习的重点.

练习册系列答案
相关题目
19.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
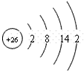
| A. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧的原子结构示意图: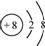 | |
| C. | NaCl的电子式: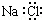 | |
| D. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl |
20.一定能在下列溶液中大量共存的离子组是( )
| A. | 水电离产生的H+浓度为1×10-12 mol•L-1的溶液:Na+、Cl-、HCO3- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、CO32- | |
| C. | 含有大量Fe3+的溶液:I-、K+、Br- | |
| D. | pH=2的水溶液中:Al3+、NH4+、CH3COO- |
14.化学与生产、生活、社会密切相关.下列说法不正确的是( )
| A. | 工厂中常用的静电除尘装置是根据胶体粒子的带电性而设计的 | |
| B. | 过氧化钠(Na2O2)常用于呼吸面具或潜水艇中作为氧气的来源 | |
| C. | 波尔多液(CuSO4)常用来配制农药,主要因为Cu2+具有氧化性 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化,主要是因为胶体的吸附性 |
1.下列各组物质两种含氧酸中,前者比后者酸性弱的是( )
| A. | H2SO4和H2SO3 | B. | (HO)2RO2和(HO)2RO3 | C. | HNO3和HNO2 | D. | H2SiO3和H4SiO4 |
18.表中的数据是破坏1mol物质中的化学键所消耗的能量:
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是A(填字母代号).
A.H2 B.Cl2C.Br2 D.I2
(2)下列氢化物中最稳定的是A(填字母代号).
A.HCl B.HBr C.HI
(3)1molCl2与足量的H2完全反应时放出 (填“吸收”或“放出”)热量185kJ.
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(1)下列物质本身具有的能量最低的是A(填字母代号).
A.H2 B.Cl2C.Br2 D.I2
(2)下列氢化物中最稳定的是A(填字母代号).
A.HCl B.HBr C.HI
(3)1molCl2与足量的H2完全反应时放出 (填“吸收”或“放出”)热量185kJ.
19.下列是四种烷烃分子的结构模型图,其中沸点最高的是( )
| A. |  | B. |  | C. |  | D. |  |
 .
.
 .
.