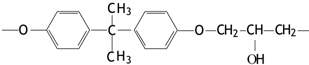
题目内容
19.下列是四种烷烃分子的结构模型图,其中沸点最高的是( )| A. |  | B. |  | C. |  | D. |  |
分析 这几种物质都是烷烃,且都是分子晶体,烷烃中碳原子个数越多其熔沸点越高,同分异构体中支链越多其熔沸点越低,据此分析解答.
解答 解:A为乙烷,B为丙烷,C为2,2-二甲基丙烷,D为正己烷,这几种物质都是烷烃,且都是分子晶体,烷烃中碳原子个数越多其熔沸点越高,同分异构体中支链越多其熔沸点越低,C、D属于同分异构体,C中支链大于D,所以熔沸点高低顺序是D>C>B>A,则熔沸点最高的是正己烷,
故选D.
点评 本题考查晶体熔沸点高低判断,明确分子晶体熔沸点与相对分子质量、氢键、烃中支链等之间的关系即可解答,题目难度不大.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
9.下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2═CH2 ③ ④CH≡CH ⑤NH3 ⑥CH4.
④CH≡CH ⑤NH3 ⑥CH4.
①BF3 ②CH2═CH2 ③
 ④CH≡CH ⑤NH3 ⑥CH4.
④CH≡CH ⑤NH3 ⑥CH4.| A. | ①②③ | B. | ①⑤⑥ | C. | ②③④ | D. | ③⑤⑥ |
10. 25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
 25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )| A. | 在pH=7.0时,溶液中含碳粒子只有CO32-和HCO3- | |
| B. | 0.1 mol•L-1Na2CO3溶液pH=13 | |
| C. | H2CO3的Ka2=1.0×10-10.25 | |
| D. | 向100 mL 0.1 mol•L-1碳酸钠溶液中滴加盐酸至溶液pH=4.0,生成标准状况下CO2气体224 mL |
7.根据图中包含的信息分析,下列叙述正确的是( )
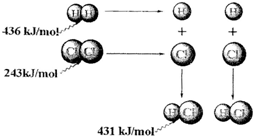

| A. | 氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量 | |
| B. | 436 kJ/mol是指断开1 mol H2中的H-H键需要放出436 kJ的能量 | |
| C. | 431kJ/mol是指生成2 mol HCl中的H-Cl键需要放出431 kJ的能量 | |
| D. | 氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量 |
4.下列叙述中正确的是( )
| A. | 分子式相同,各元素的质量分数也相同的物质是同种物质 | |
| B. | 通式相同的不同物质一定是同分异构体 | |
| C. | 分子式相同的不同物质一定是同分异构体 | |
| D. | 相对分子质量相同的不同物质一定是同分异构体 |
11.NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 标准状况下,11.2L的乙烷所含的分子数为0.5NA | |
| B. | 0.5mol C3H8分子中含C-H共价键4NA | |
| C. | 11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA |
8.短周期元素X、Y、Z、W、M、N的原子序数依次增大,且X、Y、Z、W、原子序数之和为22,最外层电子数之和为16,其中X与M同主族,W与N同主族,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构.Z2X4常做火箭推进剂的燃料,X2W2为常见的18电子化合物下列说法正确的是( )
| A. | X、Y、Z、W、M、N的原子半径的大小关系为:N>M>W>Y>Z>X | |
| B. | X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物 | |
| C. | 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 | |
| D. | 由X、W、M、N四种元素形成的化合物的溶于水,水溶液一定呈酸性 |
7.部分中学化学常见元素的原子结构和性质如下表所示:
请用元素符号或化学式回答下列问题:
(1)C、D、E的简单离子的半径由大到小的顺序为N3->Na+>Al3+.
(2)B元素有多种同位素,写出其中带8个中子的原子符号146C.
(3)由A和C组成的六原子化合物甲(C2A4)可用作发射卫星时的燃料,用NO2为氧化剂,这两种物质反应生成氮气和水蒸气.已知:
①N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJ•mol-1
②甲(g)+O2 (g)═N2(g)+2H2O(g)△H2=-534kJ•mol-1
写出甲与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1.
(4)A与C能形成离子化合物A5C,A5C中既含离子键又含共价键,其电子式为 ,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.
,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.
(5)E的单质可以和D的最高价氧化物对应的水化物反应,写出其反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,F的最高价氧化物对应的水化物和E的最高价氧化物对应的水化物可以发生反应,试写出其反应的离子方程式3H++Al(OH)3=Al3++3H2O.
| 元素代号 | 部分特征 |
| A | 气态单质在标准状况下密度是0.0893g/L |
| B | 形成的化合物的种类最多 |
| C | 形成的氧化物的种类最多 |
| D | 形成的化合物焰色反应呈黄色 |
| E | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
| F | 最高价氧化物对应的水化物酸性在短周期中最强 |
(1)C、D、E的简单离子的半径由大到小的顺序为N3->Na+>Al3+.
(2)B元素有多种同位素,写出其中带8个中子的原子符号146C.
(3)由A和C组成的六原子化合物甲(C2A4)可用作发射卫星时的燃料,用NO2为氧化剂,这两种物质反应生成氮气和水蒸气.已知:
①N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJ•mol-1
②甲(g)+O2 (g)═N2(g)+2H2O(g)△H2=-534kJ•mol-1
写出甲与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1.
(4)A与C能形成离子化合物A5C,A5C中既含离子键又含共价键,其电子式为
 ,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.
,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.(5)E的单质可以和D的最高价氧化物对应的水化物反应,写出其反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,F的最高价氧化物对应的水化物和E的最高价氧化物对应的水化物可以发生反应,试写出其反应的离子方程式3H++Al(OH)3=Al3++3H2O.
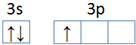 ,第一电离能:镁大于(填“大于”或“小于”)铝.
,第一电离能:镁大于(填“大于”或“小于”)铝.