题目内容
5.下列离子方程式书写正确的是( )| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Cu与稀硝酸的反应 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | CaCO3与盐酸反应 CO32-+2H+═CO2↑+H2O | |
| D. | 实验室用浓盐酸和二氧化锰反应 MnO2+2H++2Cl-═Mn2++Cl2↑+H2O |
分析 A.铁与稀硫酸反应生成硫酸亚铁和氢气;
B.铜与稀硝酸反应生成硝酸铜、NO气体和水;
C.碳酸钙为难溶物,离子方程式中不能拆开;
D.该反应需要在加热条件下进行,且不满足电荷守恒.
解答 解:A.铁和稀硫酸反应生成的是亚铁离子,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.Cu与稀硝酸的反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故B正确;
C.碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故C错误;
D.实验室用浓盐酸和二氧化锰反应生成氯化锰、氯气和水,正确的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
15.下列离子反应方程式书写正确的是( )
| A. | 向Ba(OH)2溶液滴加NaHSO4溶液至沉淀恰好完全:Ba 2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 用Pt 电极电解MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 往漂白粉溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 苯酚钠溶液与氯化铝溶液反应 3C6H5O-+Al3++3H2O═3C6H5OH+Al(OH)3↓ |
16.下列物质中,属于盐类的是( )
| A. | Na2O | B. | Ca(OH)2 | C. | CaCO3 | D. | H2SO4 |
13.工业上用含有少量氧化铁杂质的废铜粉为原料,制取硫酸铜的主要过程如下图所示:
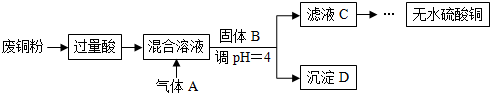
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A. | “过量酸”不适合用硝酸或浓硫酸,固体B可以用CuO、Cu(OH)2或Cu2(OH)2CO3 | |
| B. | 通入的气体A可以是O2或Cl2 | |
| C. | 通入气体A之前的混合溶液中存在的阳离子是:Fe2+、Cu2+、H+ | |
| D. | 将从溶液中得到的硫酸铜晶体在空气中加热,可制得无水硫酸铜 |
20.下列物质转化关系中,需要加入适当氧化剂的是( )
| A. | HCl→Cl2 | B. | MnO4→Mn2+ | C. | SO3→SO42- | D. | CO2→CO |
10.在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A. | K+、Cu2+、NO3-、SO42-- | B. | K+、Na+、Cl-、SiO32- | ||
| C. | Al3+、NH4+、NO3-、Cl- | D. | K+、Na+、AlO2-、Cl |
14.人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是( )
| A. | 亚硝酸盐是还原剂 | B. | 维生素C是氧化剂 | ||
| C. | 维生素C被氧化 | D. | 亚硝酸盐发生氧化反应 |
15.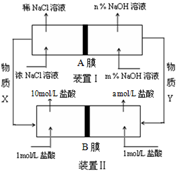 将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
 将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )| A. | 装置I为电解池,装置II为原电池 | |
| B. | 物质X为氯气,物质Y为氢气 | |
| C. | A膜为阳离子交换膜,B膜为阴离子交换膜 | |
| D. | 装置Ⅰ中,m小于n,装置II中a等于1 |