题目内容
3.黄铜矿(CuFeS2)是炼铜的最主要矿物,在野外很容易被误会为黄金,又称愚人金.
(1)火法冶炼黄铜矿的过程中,利用了Cu2O与Cu2S反应生成Cu单质,反应的化学方程式是2Cu2O+Cu2S$\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑.
(2)S位于周期表中ⅥA族,该族元素氢化物中,H2Te比H2S沸点高的原因是两者均为分子晶体且结构相似,H2Te相对分子质量比H2S大,分子间作用力更强,H2O比H2Te沸点高的原因是两者均为分子晶体,H2O分子中存在氢键.
(3)S有+4和+6两种价态的氧化物,回答下列问题:
①下列关于气态SO3和SO2的说法中,正确的是AD.
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤对电子数目相等 D.都含有极性键
②将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图1,此固态SO3中S原子的杂化轨道类型是sp3.
(4)Cu有+1和+2两种价态的化合物,回答下列问题:
①Cu+的价层电子排布为3d10,Cu2+有1个未成对电子.
②新制的Cu(OH)2能够溶解于过量浓碱溶液中,反应的离子方程式是Cu(OH)2+2OH-=[Cu(OH)4]2-.
(5)CuFeS2的晶胞如图2所示,晶胞参数a=0.524nm,c=1.032nm;CuFeS2的晶胞中每个Cu原子与4个S原子相连,列式计算晶体密度 ρ=$\frac{4×184g/mol}{6.02×1{0}^{23}mo{l}^{-1}×(0.524×1{0}^{-7}cm)^{2}×1.032×1{0}^{-7}cm}$ g•cm-3.
分析 (1)Cu2O与Cu2S反应生成Cu单质,还生成二氧化硫;
(2)S的原子结构有3个电子层,最外层电子数为6,H2Te、H2S中相对分子质量大的沸点高,而水中含氢键;
(3)①SO3中价电子对为3,没有孤对电子,为平面三角形;而SO2中价电子数为3,孤对电子数为1,为V型;
②图1中固态SO3中S原子形成4个共价单键;
(4)①Cu的原子序数为29,价电子为3d104s1,Cu2+中3d轨道上有9个电子;
②新制的Cu(OH)2能够溶解于过量浓碱溶液,生成络离子;
(5)由面心上Cu与2个S相连,晶胞中每个Cu原子与4个S相连;结合ρ=$\frac{m}{V}$计算.
解答 解:(1)Cu2O与Cu2S反应生成Cu单质,还生成二氧化硫,反应为2Cu2O+Cu2S$\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑,故答案为:2Cu2O+Cu2S$\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑;
(2)S的原子结构有3个电子层,最外层电子数为6,位于第ⅥA族,H2Te、H2S中相对分子质量大的沸点高,则H2Te沸点高,H2O比H2Te沸点高的原因是两者均为分子晶体,H2O分子中存在氢键,
故答案为:ⅥA;两者均为分子晶体且结构相似,H2Te相对分子质量比H2S大,分子间作用力更强;两者均为分子晶体,H2O分子中存在氢键;
(3)①SO3中价电子对为3,没有孤对电子,为平面三角形;而SO2中价电子数为3,孤对电子数为1,为V型,则
A.中心原子的价层电子对数目相等,故A正确;
B.三氧化硫是非极性分子,故B错误;
C.中心原子的孤对电子数目不等,故C错误;
D.都含有S与O之间的极性键,故D正确;
故答案为:AD;
②图1中固态SO3中S原子形成4个共价单键,的杂化轨道类型是sp3,故答案为:sp3;
(4)①Cu的原子序数为29,价电子为3d104s1,Cu+的价层电子排布为3d10,Cu2+中3d轨道上有9个电子,只有1个单电子,故答案为:3d10;1;
②新制的Cu(OH)2能够溶解于过量浓碱溶液,生成络离子,反应的离子方程式是为Cu(OH)2+2OH-=[Cu(OH)4]2-,故答案为:Cu(OH)2+2OH-=[Cu(OH)4]2-;
(5)由面心上Cu与2个S相连,晶胞中每个Cu原子与4个S相连;8个S均在体内,由化学式为CuFeS2,则含晶胞质量为$\frac{4×184g/mol}{{N}_{A}}$,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=$\frac{m}{V}$=$\frac{4×184g/mol}{6.02×1{0}^{23}mo{l}^{-1}×(0.524×1{0}^{-7}cm)^{2}×1.032×1{0}^{-7}cm}$g•cm-3,
故答案为:4;$\frac{4×184g/mol}{6.02×1{0}^{23}mo{l}^{-1}×(0.524×1{0}^{-7}cm)^{2}×1.032×1{0}^{-7}cm}$.
点评 本题考查晶胞计算及杂化等,为高考常见题型和高频考点,侧重于学生的分析能力的考查,把握物质结构与性质、晶胞结构及计算等为解答该题的关键,题目难度较大.

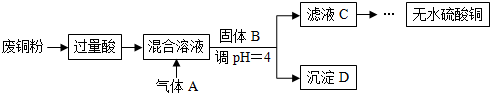
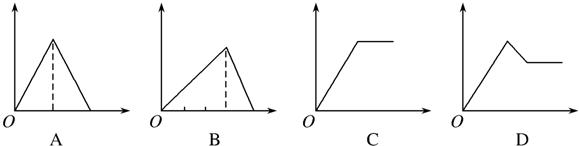
下列有关说法不正确的是( )
| A. | “过量酸”不适合用硝酸或浓硫酸,固体B可以用CuO、Cu(OH)2或Cu2(OH)2CO3 | |
| B. | 通入的气体A可以是O2或Cl2 | |
| C. | 通入气体A之前的混合溶液中存在的阳离子是:Fe2+、Cu2+、H+ | |
| D. | 将从溶液中得到的硫酸铜晶体在空气中加热,可制得无水硫酸铜 |
| A. | 亚硝酸盐是还原剂 | B. | 维生素C是氧化剂 | ||
| C. | 维生素C被氧化 | D. | 亚硝酸盐发生氧化反应 |
| A. | 在蒸馏水中滴加浓H2SO4,Kw不变 | |
| B. | CaCO3不易溶于稀硫酸,也不易溶于醋酸 | |
| C. | NaCI溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 在Na2S稀溶液中,c(H+)=c( OH-)-2c(H2S)-c(HS-) |
| A. | 简单离子半径:W>Y>X | |
| B. | Z与W形成的化合物在熔融状态下能导电 | |
| C. | 电解Y、W形成的化合物,无论是熔融状态下还是水溶液中,都能得到单质W | |
| D. | 单质X与单质Y加热条件下能生成白色固体 |
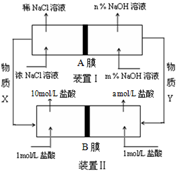 将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )| A. | 装置I为电解池,装置II为原电池 | |
| B. | 物质X为氯气,物质Y为氢气 | |
| C. | A膜为阳离子交换膜,B膜为阴离子交换膜 | |
| D. | 装置Ⅰ中,m小于n,装置II中a等于1 |
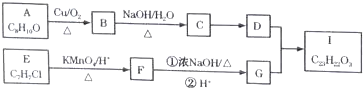
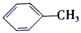 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$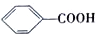
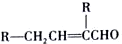
 .
. .
.