题目内容
6.常温下,下列说法正确的是( )| A. | 分别中和pH相同的等体积的盐酸和醋酸溶液,消耗等量的NaOH | |
| B. | pH=a的CH3COOH溶液加水稀释10n倍后,pH=a+n | |
| C. | pH相等的CH3COONa、NaOH溶液中,水的电离程度相同 | |
| D. | Na2CO3溶液中:c(OH-)=c(H+)+c(HCO${\;}_{3}^{-}$)+2c(H2CO3) |
分析 A.醋酸为弱酸,pH相等时醋酸的浓度较大,消耗的氢氧化钠的物质的量较大;
B.醋酸在稀释过程中电离程度增大,则稀释10n倍后,溶液的pH变化小于n;
C.氢氧化钠抑制了水的电离,醋酸钠促进了水的电离;
D.根据碳酸钠溶液中的质子守恒判断.
解答 解:A.分别中和pH相同的等体积的盐酸和醋酸溶液,醋酸为弱酸,则醋酸的浓度大于盐酸,则醋酸消耗的NaOH较多,故A错误;
B.pH=a的CH3COOH溶液加水稀释10n倍后,稀释过程中醋酸的电离程度增大,则稀释10n倍后,溶液的pH变化小于n,即稀释后溶液的pH<a+n<7,故B错误;
C.pH相等的CH3COONa、NaOH溶液中,前者醋酸根离子水解促进了水的电离,而后者氢氧化钠电离出的氢氧根离子抑制了水的电离,所以水的电离程度不同,故C错误;
D.Na2CO3溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D正确;
故选D.
点评 本题考查了弱电解质的电离及其影响、离子浓度大小比较、溶液pH的计算等知识,题目难度中等,明确弱电解质的电离及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
16.下列物质中,属于盐类的是( )
| A. | Na2O | B. | Ca(OH)2 | C. | CaCO3 | D. | H2SO4 |
14.人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是( )
| A. | 亚硝酸盐是还原剂 | B. | 维生素C是氧化剂 | ||
| C. | 维生素C被氧化 | D. | 亚硝酸盐发生氧化反应 |
11.下列有关电解质溶液的说法正确的是( )
| A. | 在蒸馏水中滴加浓H2SO4,Kw不变 | |
| B. | CaCO3不易溶于稀硫酸,也不易溶于醋酸 | |
| C. | NaCI溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 在Na2S稀溶液中,c(H+)=c( OH-)-2c(H2S)-c(HS-) |
15.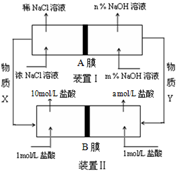 将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
 将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )| A. | 装置I为电解池,装置II为原电池 | |
| B. | 物质X为氯气,物质Y为氢气 | |
| C. | A膜为阳离子交换膜,B膜为阴离子交换膜 | |
| D. | 装置Ⅰ中,m小于n,装置II中a等于1 |
16.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1的某二元弱碱的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| B. | 25℃时,pH=12的氨水和pH=12的盐酸等体积混合:c(Cl-)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| C. | 等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合:c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO${\;}_{4}^{2-}$)+c(NH${\;}_{4}^{+}$)+c(H+)+c(OH-) |

 +Br2
+Br2
 +HO-NO2
+HO-NO2
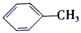 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$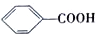
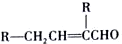
 .
. .
.