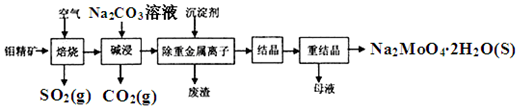
题目内容
18.下列关于浓硝酸的说法正确的是( )| A. | 保存在棕色瓶中 | B. | 不易挥发 | C. | 与铜不反应 | D. | 受热不分解 |
分析 浓硝酸为强氧化性酸,常温下可与铜反应,浓硝酸易挥发,见光易分解,所以保存在棕色瓶中,以此解答该题
解答 解:A.浓硝酸见光易分解,所以保存在棕色瓶中,故A正确;
B.浓硝酸易挥发,故B错误;
C.浓硝酸为强氧化性酸,常温下可与铜反应,故C错误;
D.浓硝酸见光易分解,故D常温.
故选A.
点评 本题考查了浓硝酸的性质,为高频考点,侧重于双基的考查,明确浓硝酸具有挥发性、不稳定性、强氧化性是解本题关键,题目难度不大.

练习册系列答案
相关题目
8.室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.lmol.L-1的三种酸HA、HB和HD溶液,pH随NaOH溶液体积变化如图.下列说法不正确的是( )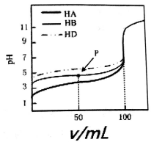

| A. | HA、HB和HD均为弱酸 | |
| B. | P点时,c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 三种酸溶液分别被NaOH溶液恰好完全中和后互混:c(HA)+c(HB)+c(HD)═c(OH-)-c(H+) |
9.下列四种有机物在一定条件下不能作为合成高分子化合物单体的是( )
| A. | 丙烯酸H2C═CHCOOH | B. | 乳酸CH3CH(OH)COOH | ||
| C. | 甘氨酸NH2CH2COOH | D. | 丙酸CH3CH2COOH |
6.将 6.4g 铜与 140mL 一定浓度的硝酸反应,铜完全溶解产生的 NO 和 NO2混合气体的体积为 3.36L(标准状况),其中 NO 的体积为(标准状况)( )
| A. | 0.56 L | B. | 1.344 L | C. | 2.016 L | D. | 2.8 L |
13.下列气体可用如图所示方法收集的是( )
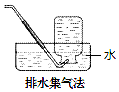

| A. | NO2 | B. | O2 | C. | SO2 | D. | NH3 |
8.常温下,向1LpH=10的KOH溶液中持续通入CO2,与溶液中水电离出的c(OH-)与通入的CO2的体积(V)关系如图所示.下列叙述不正确的是( )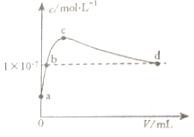

| A. | b点溶液呈中性 | |
| B. | d点溶液中:c(K+)=2c(CO32-)+c(HCO3-) | |
| C. | c点溶液中:2c(H2CO3)+c(H+)+c(HCO3-)=c(OH-) | |
| D. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 |
9.向3mol•L-1盐酸中加入打磨后的镁条,一段时间后生成灰白色固体X,并测得反应后溶液pH升高.为确认固体X的成分,过滤洗涤后进行实验:
①向固体X中加入足量硝酸,固体溶解,得到无色溶液,将其分成两等份;
②向其中一份无色溶液中加入足量AgNO3溶液,得到白色沉淀a;
③向另一份无色溶液中加入足量NaOH溶液,得到白色沉淀b.
下列分析不正确的是( )
①向固体X中加入足量硝酸,固体溶解,得到无色溶液,将其分成两等份;
②向其中一份无色溶液中加入足量AgNO3溶液,得到白色沉淀a;
③向另一份无色溶液中加入足量NaOH溶液,得到白色沉淀b.
下列分析不正确的是( )
| A. | 溶液pH升高的主要原因:Mg+2H+═Mg2++H2↑ | |
| B. | 生成沉淀a的离子方程式:Ag++Cl-═AgCl↓ | |
| C. | 沉淀b是Mg(OH)2 | |
| D. | 若a、b的物质的量关系为n(a):n(b)=1:3,则可推知固体X的化学式为Mg3(OH)6Cl |