题目内容
6.将 6.4g 铜与 140mL 一定浓度的硝酸反应,铜完全溶解产生的 NO 和 NO2混合气体的体积为 3.36L(标准状况),其中 NO 的体积为(标准状况)( )| A. | 0.56 L | B. | 1.344 L | C. | 2.016 L | D. | 2.8 L |
分析 n(Cu)=$\frac{6.4g}{64g/mol}$=0.1mol,n(NOx)=$\frac{3.36L}{22.4L/mol}$=0.15mol,铜失电子、氮原子得电子生成氮氧化物,该反应中得失电子守恒,根据转移电子守恒、氮原子守恒列方程式进行计算.
解答 解:n(Cu)=$\frac{6.4g}{64g/mol}$=0.1mol,n(NOx)=$\frac{3.36L}{22.4L/mol}$=0.15mol,设NO的物质的量为x,NO2的物质的量为y,根据氮原子守恒、电子守恒得
$\left\{\begin{array}{l}{x+y=0.15}\\{(5-2)x+(5-4)y=0.1×2}\end{array}\right.$解得$\left\{\begin{array}{l}{x=0.025}\\{y=0.125}\end{array}\right.$
所以V(NO)=0.025×22.4L/mol=0.56L,故A正确;
故选A.
点评 本题考查化学反应方程式的计算,守恒思想思想的运用为解答的关键,注意对应关系,题目难度不大.

练习册系列答案
相关题目
17.化学与社会、生活密切相关.下列有关说法错误的是( )
| A. | “84”消毒液中的NaClO有强氧化性,可杀菌消毒 | |
| B. | 使用Na2CO3溶液比使用洗涤剂淸洗餐具更环保 | |
| C. | 铝、氧化铝烧结成的金属陶瓷能耐高温、不易破碎 | |
| D. | 钙、铁、锌、铜、碘是人体必需的微量元素 |
14.用NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 2 mol•L-1的AlC13溶液中含有Al3+的数目小于2NA | |
| B. | 用石灰乳完全吸收1 molCl2时,转移的电子数为2 NA | |
| C. | 标准状况下,1 mol CH3Cl中含有的共价键数目为4 NA | |
| D. | 标准状况下,分子数均为NA 的O2与NO混合后,气体的体积约为44.8 L |
11.在铁的氧化物和氧化铝组成的混合物中,加入 2mol/L 硫酸溶液 65mL,恰好完全反应,所得溶液中Fe2+能被标准状况下 112mL 氯气氧化.则原混合物中金属元素和氧元素的原子个数之比为( )
| A. | 9:13 | B. | 5:7 | C. | 4:3 | D. | 3:4 |
18.下列关于浓硝酸的说法正确的是( )
| A. | 保存在棕色瓶中 | B. | 不易挥发 | C. | 与铜不反应 | D. | 受热不分解 |
17.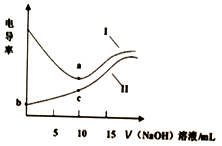 用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )
 用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )| A. | b点pH值大于1 | B. | 盐酸浓度为 0.lmol•L-1 | ||
| C. | c点:c(Na+)>c(A-)>c(H+)>c(OH-) | D. | 曲线Ⅰ为盐酸,曲线Ⅱ为醋酸溶液 |
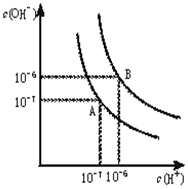 水的电离平衡曲线如下图所示.
水的电离平衡曲线如下图所示. 无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图(夹持仪器略去),主要步骤如下:
无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图(夹持仪器略去),主要步骤如下: