题目内容
13.下列气体可用如图所示方法收集的是( )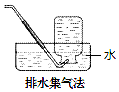
| A. | NO2 | B. | O2 | C. | SO2 | D. | NH3 |
分析 常用的有排水法和排空气法,若密度比空气的大,采用向上排空气法,若密度比空气的小,采用向下排空气法.能用排水法收集说明该气体难溶于水,和水也不反应.
A.二氧化氮和水反应;
B.氧气难溶于水;
C.二氧化硫易溶于水;
D.氨气极易溶于水.
解答 解:A.二氧化氮和水反应生成硝酸和一氧化氮,不能用排水法收集,故A错误;
B.氧气难溶于水,可以用排水取气法收集,故B正确;
C.二氧化硫易溶于水和水反应生成亚硫酸,不能用排水法收集,故C错误;
D.氨气极易溶于水,不能用排水法收集,故D错误;
故选B.
点评 本题考查气体的收集方法,应熟悉常用的气体收集方法,排空气法要根据气体的密度来确定,但排空气法收集的气体不是很纯;气体用排水法收集的较纯,能用排水法收集说明该气体难溶于水,和水也不反应,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.将nmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )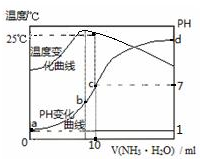

| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH4+)=c(Cl-)=1.0mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)=(n-1)×10-7 |
4.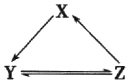 下表所列各组物质中,物质之间通过一步反应不能实砚如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应不能实砚如图所示转化的是( )
 下表所列各组物质中,物质之间通过一步反应不能实砚如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应不能实砚如图所示转化的是( )| 选项 | X | Y | Z |
| A | Na | NaOH | NaCl |
| B | Si | SiO2 | Na2SiO3 |
| C | Cl2 | HClO | NaClO |
| D | NO | NO2 | HNO3 |
| A. | A | B. | B | C. | C | D. | D |
8.金属性最强的元素是( )
| A. | Li | B. | Na | C. | Mg | D. | K |
18.下列关于浓硝酸的说法正确的是( )
| A. | 保存在棕色瓶中 | B. | 不易挥发 | C. | 与铜不反应 | D. | 受热不分解 |
6.a g 下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a的选项有( )
| A. | HCHO | B. | CH3COOCH2CH3 | C. | HOOCCOOH | D. | HCOOH |
3.食醋(主要成分CH3COOH)、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质.己知:
请回答下列问题:
(1)25℃时,0.10mol•L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-)=10-3
(2)常温下,将20mL0.10mol•L-1CH3COOH溶液和 20mL0.10mol•L-1HNO2 溶液分别与 20mL 0.10mol•L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计).
①反应开始时,v (CH3COOH )<v (HNO2)(填“>”、“<”或“:”).
②充分反应后.两溶液中c(CH3COO-)< c(NO2-)(填“>”、“<”或“=”).
(3)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18;
(4)常温下,下列方法可以使0.1mol•L-1CH3COOH的电离程度增大的是bc.
a.加入少量的稀盐酸
b.加热溶液
c.加水稀释
d.加入少量冰醋酸.
| 弱酸 | CH3COOH | H2CO3 | HNO2 |
| 电离常数 | K=1.8×10-5 | K=4.3×10-7 K=5.6×10-11 | K=5.0×10-4 |
(1)25℃时,0.10mol•L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-)=10-3
(2)常温下,将20mL0.10mol•L-1CH3COOH溶液和 20mL0.10mol•L-1HNO2 溶液分别与 20mL 0.10mol•L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计).
①反应开始时,v (CH3COOH )<v (HNO2)(填“>”、“<”或“:”).
②充分反应后.两溶液中c(CH3COO-)< c(NO2-)(填“>”、“<”或“=”).
(3)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18;
(4)常温下,下列方法可以使0.1mol•L-1CH3COOH的电离程度增大的是bc.
a.加入少量的稀盐酸
b.加热溶液
c.加水稀释
d.加入少量冰醋酸.
4.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 100 mL 0.2 mol•L-1蔗糖溶液中所含分子总数为0.02NA | |
| B. | 40mL 10mol•L-1的浓盐酸与足量的MnO2充分反应,生成氯气的分子数为0.1NA | |
| C. | 标准状况下,22.4L CHCl3中含有的氯原子数目为3NA | |
| D. | 14g CO 和N2混合气体中含有的电子总数为7NA |
 无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图(夹持仪器略去),主要步骤如下:
无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图(夹持仪器略去),主要步骤如下: