题目内容
14.关于化学键的叙述中,正确的是( )| A. | 离子化合物中可能含共价键 | B. | 共价化合物中可能含离子键 | ||
| C. | 氢键也是一种化学键 | D. | 离子化合物中一定含有金属离子 |
分析 含有离子键的化合物为离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,多原子分子都只含共价键.
解答 解:A.离子化合物中可能含有共价键,如NaOH等,故A正确;
B.只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,故B错误;
C.氢键是分子间作用力,不属于化学键,故C错误;
D.离子化合物中不一定含有金属元素,如铵盐,故D错误;
故选A.
点评 本题考查化学键判断,为高频考点,化学键包含离子键、共价键和金属键,氢键属于分子间作用力,不属于化学键,易错选项是C.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 烷烃C5H12的同分异构体中,主链最短的一种系统命名为2,2-甲基丙烷 | |
| B. | 用酸性KMnO4 溶液可鉴别2-丁烯和正丁醛 | |
| C. | 由甘氨酸、丙氨酸形成的二肽有4种 | |
| D. | A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同 |
5.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色.
(1)C元素在元素周期表中的位置第三周期第ⅥA族.B形成的简单离子的结构示意图 .
.
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示A、D形成化合物的过程: .
.
(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
(5)GE2的电子式为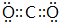 ,F与G形成的最简单的化合物的结构式为
,F与G形成的最简单的化合物的结构式为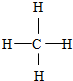 .
.
(6)E的氢化物比C的氢化物的熔沸点高的原因是H2O分子间存在氢键,H2S分子间不存在氢键.
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示)Mg>Al>S>O.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)C元素在元素周期表中的位置第三周期第ⅥA族.B形成的简单离子的结构示意图
 .
.(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示A、D形成化合物的过程:
 .
.(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
(5)GE2的电子式为
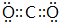 ,F与G形成的最简单的化合物的结构式为
,F与G形成的最简单的化合物的结构式为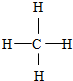 .
.(6)E的氢化物比C的氢化物的熔沸点高的原因是H2O分子间存在氢键,H2S分子间不存在氢键.
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示)Mg>Al>S>O.
19.处于固体状态的下列物质,其晶体类型按照离子晶体、分子晶体、原子晶体顺序排列的是( )
| A. | CH3COONH4、H2O、水晶 | B. | H2SO4、硫磺、石墨 | ||
| C. | KOH、SO3、Ar | D. | Ba(OH)2、玻璃、金刚石 |
3.下列关于金属腐蚀与防护的说法不正确的是( )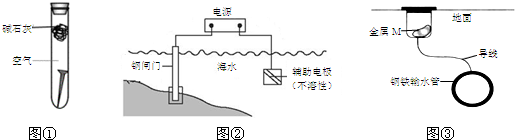

| A. | 图①,放置于干燥空气中的铁钉不会生锈 | |
| B. | 图②,若断开电源,钢闸门将发生吸氧腐蚀 | |
| C. | 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀 | |
| D. | 图③,若金属M比Fe活泼,可防止输水管腐蚀 |
4.下列实验操作正确的是( )


| A. | 中和滴定时,锥形瓶先用蒸馏水润洗,再用待测液润洗 | |
| B. | 检验某溶液中含有Na+无K+时,用洁净的铂丝蘸取该溶液,灼烧,观察火焰颜色 | |
| C. | 用图1所示装置,将Cl2和HCl的混合气体通过饱和NHCO3溶液,除去Cl2中HCl | |
| D. | 用图2所示装置,向含有少量水的乙醇中加入足量生石灰,蒸馏,得到无水乙醇 |
 ;
;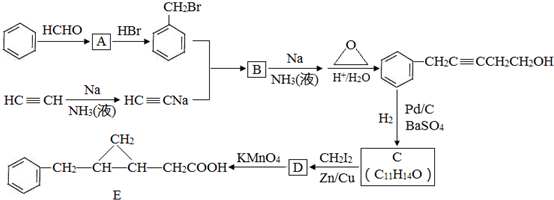
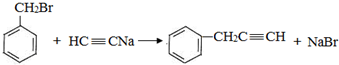 ,反应类型是取代反应.
,反应类型是取代反应.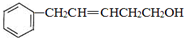 ,C的分子中一定共面的碳原子最多有7个.
,C的分子中一定共面的碳原子最多有7个. 任意2种.
任意2种. .
.