题目内容
12.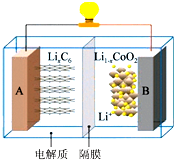 钴酸锂(LiCoO2)电池工作原理如图,A 极材料是金属锂和石墨的复合材料(石墨作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
钴酸锂(LiCoO2)电池工作原理如图,A 极材料是金属锂和石墨的复合材料(石墨作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 充电时Li+由A极区域移向B极区域 | |
| B. | 充电时,A为阴极,发生还原反应C6+xLi++xe-=LixC6 | |
| C. | 放电时,B为正极,电极反应式为 Li1-xCoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“充电处理”使锂进入石墨中而有利于回收 |
分析 根据电池反应式知,负极反应式为LixC6-xe-=C6+xLi+、正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,充电时,阴极、阳极反应式与负极、正极反应式正好相反,所以A是负极、B是正极,根据二次电池的工作原理结合原电池和电解池的工作原理来回答.
解答 解:根据电池反应式知,负极反应式为LixC6-xe-=C6+xLi+、正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,充电时,阴极、阳极反应式与负极、正极反应式正好相反,所以A是负极、B是正极,
A.充电时,A是阴极、B是阳极,锂离子向阴极移动,则Li+从B流向A,故A错误;
B.充电时,A为阴极,阴极上发生还原反应,则阴极反应为C6+xLi++xe-=LixC6,故B正确;
C.放电时,B为正极,正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,故C正确;
D.根据电池反应式知,充电时锂离子加入石墨中,有利于锂离子的回收,故D正确;
故选A.
点评 本题考查化学电源新型电池,侧重考查原电池和电解池原理,明确充放电各个电极上发生的反应是解本题关键,难点是电极反应式的书写,题目难度中等.

练习册系列答案
相关题目
3.下列关于金属腐蚀与防护的说法不正确的是( )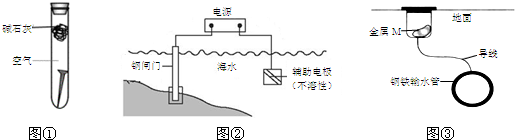

| A. | 图①,放置于干燥空气中的铁钉不会生锈 | |
| B. | 图②,若断开电源,钢闸门将发生吸氧腐蚀 | |
| C. | 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀 | |
| D. | 图③,若金属M比Fe活泼,可防止输水管腐蚀 |
20. 现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
(1)已知CA5为离子化合物,写出其电子式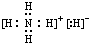 .
.
(2)A、B、C三种元素可以形成原子个数比为1:1:1的3原子化合物分子,该分子中σ键和π键的个数比为1:1.
(3)画出D基态原子的核外电子排布图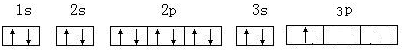 .
.
(4)C与A形成最简单化合物的沸点高于E与A形成的化合物,其原因是NH3分子之间可以形成氢键.
(5)EF3中心原子的杂化方式为sp3;用价层电子对互斥理论推测其空间构型为三角锥形.
(6)检验G元素的方法是焰色反应;请用原子结构的知识解释产生此现象的原因当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量.
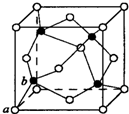
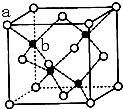
(7)H与硫元素形成的化合物HS的晶体结构如图所示,其晶胞边长为x pm,则HS晶体的密度为$\frac{97×4}{{N}_{A}×(x×1{0}^{-10})^{3}}$g•cm-3(列式即可,阿伏加德罗常数用NA表示);a与b之间的距离为$\frac{1}{4}$×$\sqrt{3}$xpm(用含x的式子表示).
 现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的最外层电子数是最内层电子数的2倍 |
| C元素原子的核外p电子数比s电子数少1 |
| D 原子的第一至第四电离能分别是: I 1=578kJ•mol-1I 2=1817kJ•mol-1 I 3=2745kJ•mol-1I 4=11575kJ•mol-1 |
| E原子核外所有p轨道全满或半满 |
| F元素的主族序数与周期序数的差值为4 |
| G 是前四周期中电负性最小的元素 |
| H在周期表的第12列 |
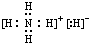 .
.(2)A、B、C三种元素可以形成原子个数比为1:1:1的3原子化合物分子,该分子中σ键和π键的个数比为1:1.
(3)画出D基态原子的核外电子排布图
 .
.(4)C与A形成最简单化合物的沸点高于E与A形成的化合物,其原因是NH3分子之间可以形成氢键.
(5)EF3中心原子的杂化方式为sp3;用价层电子对互斥理论推测其空间构型为三角锥形.
(6)检验G元素的方法是焰色反应;请用原子结构的知识解释产生此现象的原因当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量.
(7)H与硫元素形成的化合物HS的晶体结构如图所示,其晶胞边长为x pm,则HS晶体的密度为$\frac{97×4}{{N}_{A}×(x×1{0}^{-10})^{3}}$g•cm-3(列式即可,阿伏加德罗常数用NA表示);a与b之间的距离为$\frac{1}{4}$×$\sqrt{3}$xpm(用含x的式子表示).
4.下列实验操作正确的是( )


| A. | 中和滴定时,锥形瓶先用蒸馏水润洗,再用待测液润洗 | |
| B. | 检验某溶液中含有Na+无K+时,用洁净的铂丝蘸取该溶液,灼烧,观察火焰颜色 | |
| C. | 用图1所示装置,将Cl2和HCl的混合气体通过饱和NHCO3溶液,除去Cl2中HCl | |
| D. | 用图2所示装置,向含有少量水的乙醇中加入足量生石灰,蒸馏,得到无水乙醇 |
1.下列根据实验现象得出的结论正确的是( )
| A. | 将Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,则样品已变质 | |
| B. | NaBr溶液中滴入少量氯水和CCl4,震荡,有机相呈橙色,则还原性:Br->Cl- | |
| C. | 某试液中滴入BaCl2溶液和稀硝酸有白色沉淀,则试液中一定含SO42-或SO32- | |
| D. | 溴乙烷与NaOH的乙醇溶液共热,逸出的蒸气直接通入酸性高锰酸钾溶液,溶液紫色褪去,则逸出的蒸气一定为纯净的乙烯 |
10.一种信息素的结构简式为CH3(CH2)5CH═CH(CH2)9CHO,关于检验该信息素中官能团的试剂和顺序,下列说法正确的是( )
| A. | 先加入溴水;后加酸性高锰酸钾溶液 | |
| B. | 先加入银氨溶液;再另取该物质加入溴水 | |
| C. | 先加入酸性高锰酸钾溶液;后加银氨溶液,水浴加热 | |
| D. | 先加入新制氢氧化铜悬浊液,加热;酸化后再加入溴水 |
 ;
; A、B、C、D、E、F为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb
A、B、C、D、E、F为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb .
.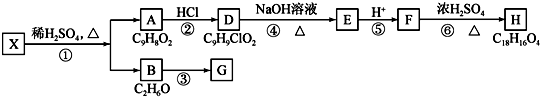
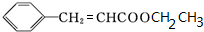 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$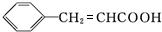 +CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.
+CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.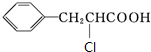 .
.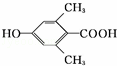 、
、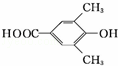 .
.