题目内容
有机化合物中的烯键跟臭氧(O3)反应,再在锌粉存在下水解,其结果是原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(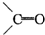 ),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
(CH3)2C═O+CH3CH═O分子式为C4H8的几种烯烃混合气体经O3氧化并在锌粉存在下水解后生成0.60mol酮和1.80mol醛(其中HCHO 0.90mol)原混合气体中,2-丁烯的体积分数为( )
 ),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3| O3 |
| Zn、H2O |
| A、0.25 | B、0.33 |
| C、0.40 | D、0.50 |
考点:化学方程式的有关计算
专题:计算题
分析:C4H8有如下三种同分异构体的烯烃:CH2═CHCH2CH3、CH3-CH═CH-CH3、CH2═C(CH3)2,根据题中信息,C4H8双键被氧化断裂的情况如下: 、
、 、
、 ,
,
三种烯烃被氧化得到的产物有:HCHO( 0.90mol)、CH3CH2CHO、CH3CHO、CH3COCH3(0.60mol),结合相关反应即可解答.
 、
、 、
、 ,
,三种烯烃被氧化得到的产物有:HCHO( 0.90mol)、CH3CH2CHO、CH3CHO、CH3COCH3(0.60mol),结合相关反应即可解答.
解答:
解:C4H8有如下三种同分异构体的烯烃:CH2═CHCH2CH3、CH3-CH═CH-CH3、CH2═C(CH3)2,经O3氧化并在锌粉存在下水解,发生反应:
①CH2═CH-CH2-CH3
HCHO+CH3CH2CHO,n(HCHO)=n(CH3CH2CHO),
②CH3-CH═CH-CH3
CH3CHO+CH3COCH3,
×n(CH3CHO)=n(CH3-CH═CH-CH3),
③CH2═C(CH3)2
HCHO+CH3CH2CHO,n(HCHO)=n(CH3COCH3)=0.60mol=n[CH2═C(CH3)2],
由③可知①中:n(HCHO)=n(CH3CH2CHO)=0.90mol-0.60mol=0.30mol=n(CH2═CH-CH2-CH3),④
由以上分析可知②中分解的2-丁烯的物质的量为
×n(CH3CHO)=n(CH3-CH═CH-CH3)=
×(1.8mol-0.9mol-0.3mol)=0.3mol,
相同条件下,原混合气体中,2-丁烯的体积分数为
×100%=25%,
故选:A.
①CH2═CH-CH2-CH3
| O3 |
| Zn、H2O |
②CH3-CH═CH-CH3
| O3 |
| Zn、H2O |
| 1 |
| 2 |
③CH2═C(CH3)2
| O3 |
| Zn、H2O |
由③可知①中:n(HCHO)=n(CH3CH2CHO)=0.90mol-0.60mol=0.30mol=n(CH2═CH-CH2-CH3),④
由以上分析可知②中分解的2-丁烯的物质的量为
| 1 |
| 2 |
| 1 |
| 2 |
相同条件下,原混合气体中,2-丁烯的体积分数为
| 0.3mol |
| 0.3mol+0.3mol+0.6mol |
故选:A.
点评:本题考查了烯烃的臭氧化,理解给予的反应信息是解题的关键,注意CH3-CH═CH-CH3断裂
×n(CH3CHO)=n(CH3-CH═CH-CH3)是易错点,题目难度中等.
| 1 |
| 2 |

练习册系列答案
相关题目
用NA表示阿伏加德罗常数,下列有关叙述正确的是( )
| A、2.24L CO2中含有的原子数为0.3NA |
| B、500mL 0.2mol/L的Fe2(SO4)3溶液中Fe3+总数为0.2NA |
| C、5.6g铁粉与硝酸完全反应失去的电子数一定为0.3NA |
| D、28g N2和CO的混合气体含有的原子总数为2NA |
成语是中华民族语言的瑰宝.下列成语中,其本意主要为化学变化的是( )
| A、铁杵磨成针 | B、木已成舟 |
| C、死灰复燃 | D、积土成山 |
 在盛有足量A的体积可变的密闭容器中通入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H>0,在一定温度、压强下达到平衡.平衡时C的物质的量与通入B的物质的量的变化关系如图所示.下列说法正确的是( )
在盛有足量A的体积可变的密闭容器中通入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H>0,在一定温度、压强下达到平衡.平衡时C的物质的量与通入B的物质的量的变化关系如图所示.下列说法正确的是( )| A、平衡时B的转化率为40% |
| B、若保持压强一定,当温度升高时,图中θ>45° |
| C、在容器中加入催化剂,则B的转化率增大 |
| D、若再通入B,则再次达平衡时C的体积分数增大 |
在天平的两个托盘上,放上质量相等的两个烧杯,在烧杯中分别加入等质量等浓度的硫酸,此时天平处于平衡状态,然后分别向两只烧杯中加入等质量的Na2CO3和NaHCO3粉末,完全反应后,则天平两边( )
| A、放Na2CO3的一端托盘下沉 |
| B、NaHCO3的一端托盘下沉 |
| C、仍保持平衡 |
| D、无法判断 |