题目内容
实验室要配制100mL1.0mol?L-1的NaCl溶液,试回答下列各题:
(1)经计算,应该用托盘天平称取NaCl固体g.
(2)若用NaCl固体配制溶液,下列仪器中,不需要用到的是 .(填序号)A.锥形瓶 B.200mL容量瓶 C.烧杯 D.胶头滴管 E.药匙
F.托盘天平 G.洗瓶
(3)下列操作中,容量瓶所不具备的功能有 (填序号).
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.量取任意体积的液体
容量瓶上除有刻度线外还应标有 、 ,且容量瓶在使用前必须 .
(4)若实验室需要配制 0.5mol/L硫酸溶液450mL,则需要质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用 mL规格的量筒最好.
(5)配制2mol/L NaOH溶液250mL,在下列所叙述的操作中选择必要的操作,用序号写出操作顺序 .
①在烧杯中放入一定量的水(少于250mL),溶解NaOH.
②在托盘天平上放2张大小一样的纸,称取20g NaOH.
③用胶头滴管加蒸馏水,使溶液凹液面和刻度相切,摇匀.
④在烧杯中放NaOH,用托盘天平称出20g NaOH.
⑤把20g NaOH溶于250mL蒸馏水中.
⑥NaOH溶液冷却后,注入容量瓶(250mL规格).
⑦向容量瓶加蒸馏水,直至液面接近瓶颈刻度线1~2cm处.
⑧容量瓶用NaOH溶液润洗后使用.
⑨用蒸馏水洗涤烧杯,并把洗涤液注入容量瓶,振荡.
(6)下列四项错误操作会导致所得溶液浓度偏高的是 (填序号).
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处.
(1)经计算,应该用托盘天平称取NaCl固体g.
(2)若用NaCl固体配制溶液,下列仪器中,不需要用到的是
F.托盘天平 G.洗瓶
(3)下列操作中,容量瓶所不具备的功能有
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.量取任意体积的液体
容量瓶上除有刻度线外还应标有
(4)若实验室需要配制 0.5mol/L硫酸溶液450mL,则需要质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
(5)配制2mol/L NaOH溶液250mL,在下列所叙述的操作中选择必要的操作,用序号写出操作顺序
①在烧杯中放入一定量的水(少于250mL),溶解NaOH.
②在托盘天平上放2张大小一样的纸,称取20g NaOH.
③用胶头滴管加蒸馏水,使溶液凹液面和刻度相切,摇匀.
④在烧杯中放NaOH,用托盘天平称出20g NaOH.
⑤把20g NaOH溶于250mL蒸馏水中.
⑥NaOH溶液冷却后,注入容量瓶(250mL规格).
⑦向容量瓶加蒸馏水,直至液面接近瓶颈刻度线1~2cm处.
⑧容量瓶用NaOH溶液润洗后使用.
⑨用蒸馏水洗涤烧杯,并把洗涤液注入容量瓶,振荡.
(6)下列四项错误操作会导致所得溶液浓度偏高的是
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)依m=CVM计算需要氯化钠的质量;
(2)依据配置一定物质的量浓度溶液的步骤选择合适的仪器;
(3)依据容量瓶的构造和使用方法及注意事项解答;
(4)要配制 0.5mol/L硫酸溶液450mL,需要选择500ml的容量瓶,先依据C=
计算浓硫酸的物质的量浓度,然后依据稀释前后溶质的物质的量不变计算需要浓硫酸的体积,据此选择合适的量筒;
(5)依据配置一定物质的量浓度溶液的一般步骤解答;
(6)根据C=
计算不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高;
(2)依据配置一定物质的量浓度溶液的步骤选择合适的仪器;
(3)依据容量瓶的构造和使用方法及注意事项解答;
(4)要配制 0.5mol/L硫酸溶液450mL,需要选择500ml的容量瓶,先依据C=
| 1000ρω |
| M |
(5)依据配置一定物质的量浓度溶液的一般步骤解答;
(6)根据C=
| n |
| V |
解答:
解:(1)要配制100mL1.0mol?L-1的NaCl溶液,需要氯化钠的质量m=0.1L×1.0mol?L-1×58.5g/mol=5.9g;
故答案为:5.9;
(2)用NaCl固体配制溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,需要的仪器有:托盘天平、钥匙、烧杯、玻璃棒、100ml容量瓶、胶头滴管,不需要的仪器有:A.锥形瓶 B.200mL容量瓶;
故选:AB;
(3)容量瓶是用来配置一定物质的量浓度溶液的精密仪器,容量瓶上标有温度、容积、刻度线,使用前应检查是否漏水,不能用来溶解固体、稀释溶液、长期存放溶液,不能用作反应容器,容积固定,不能量取任意体积液体;
故答案为:BCD;
(4)98%、密度为1.84g/cm3的浓硫酸的物质的量浓度C=
=18.4mol/L,要配置450mL溶液应选择500ml容量瓶,设需要浓硫酸的体积为V,依据稀释前后溶质的物质的量不变得V×18.4mol/L=0.5mol/L
×500ml,解得V=13.6ml,应选择25ml的量筒;
故答案为:13.6;25;
(5)配制2mol/L NaOH溶液250mL的一般操作步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,
故答案为:416973;
(6)A.定容时仰视容量瓶刻度线,导致溶液的体积偏大,溶液的浓度偏低,故A错误;
B.定容时俯视容量瓶刻度线,导致溶液的体积偏小,溶液的浓度偏高,故B正确;
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作,没进行洗涤操作,导致溶质的物质的量偏小,溶液的浓度偏低,故C错误;
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,导致溶液的体积偏大,溶液的浓度偏低,故D错误;
故选:B.
故答案为:5.9;
(2)用NaCl固体配制溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,需要的仪器有:托盘天平、钥匙、烧杯、玻璃棒、100ml容量瓶、胶头滴管,不需要的仪器有:A.锥形瓶 B.200mL容量瓶;
故选:AB;
(3)容量瓶是用来配置一定物质的量浓度溶液的精密仪器,容量瓶上标有温度、容积、刻度线,使用前应检查是否漏水,不能用来溶解固体、稀释溶液、长期存放溶液,不能用作反应容器,容积固定,不能量取任意体积液体;
故答案为:BCD;
(4)98%、密度为1.84g/cm3的浓硫酸的物质的量浓度C=
| 1000×1.84g/ml×98% |
| 98g/mol |
×500ml,解得V=13.6ml,应选择25ml的量筒;
故答案为:13.6;25;
(5)配制2mol/L NaOH溶液250mL的一般操作步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,
故答案为:416973;
(6)A.定容时仰视容量瓶刻度线,导致溶液的体积偏大,溶液的浓度偏低,故A错误;
B.定容时俯视容量瓶刻度线,导致溶液的体积偏小,溶液的浓度偏高,故B正确;
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作,没进行洗涤操作,导致溶质的物质的量偏小,溶液的浓度偏低,故C错误;
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,导致溶液的体积偏大,溶液的浓度偏低,故D错误;
故选:B.
点评:本题考查了一定物质的量浓度溶液的配制,熟悉配置的过程和注意事项是解题关键,注意容量瓶的构造和使用方法及误差分析的技巧,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列方程式书写正确的是( )
| A、NaHCO3在水溶液中的电离方程式:NaHCO3?Na++HCO3- |
| B、H2SO3的电离方程式H2SO3?2H++SO32- |
| C、CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
| D、HS-的水解方程式:HS-+H2O?H2S+OH- |
下列叙述正确的是( )
| A、氢氟酸不能保存在玻璃瓶内,也不和任何酸性氧化物反应 |
| B、实验室储存少量溴时,往往在液面上加少量水,防止溴被氧化 |
| C、氟化氢在空气中呈现白雾,这种白雾有剧毒 |
| D、碘化钾水溶液能使淀粉变蓝 |
有机化合物中的烯键跟臭氧(O3)反应,再在锌粉存在下水解,其结果是原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(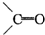 ),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
(CH3)2C═O+CH3CH═O分子式为C4H8的几种烯烃混合气体经O3氧化并在锌粉存在下水解后生成0.60mol酮和1.80mol醛(其中HCHO 0.90mol)原混合气体中,2-丁烯的体积分数为( )
 ),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3| O3 |
| Zn、H2O |
| A、0.25 | B、0.33 |
| C、0.40 | D、0.50 |
如图象纵坐标表示沉淀量,横坐标表示加入x的物质的量,下列实验内容与图象正确的组合是( )

①NaAlO2溶液中滴入HCl
②盐酸酸化的MgCl2、AlCl3溶液中滴入NaOH溶液
③NaOH溶液中滴入AlCl3溶液
④AlCl3溶液中滴入NH3?H2O.

①NaAlO2溶液中滴入HCl
②盐酸酸化的MgCl2、AlCl3溶液中滴入NaOH溶液
③NaOH溶液中滴入AlCl3溶液
④AlCl3溶液中滴入NH3?H2O.
| A、①a | B、②b | C、③c | D、④d |
下列叙述错误的是( )
| A、苯、乙烯都既能发生加成反应,也能发生氧化反应 |
| B、塑料、橡胶和合成纤维都属于有机高分子化合物 |
| C、糖类、脂肪和蛋白质在一定条件下都能发生水解反应 |
| D、分子式为C12H22O11的糖有蔗糖和麦芽糖,它们属于同分异构体 |
下列关于氮族元素的说法中不正确的是( )
| A、原子的最外层均有5个电子,最高价均为+5价 |
| B、非金属性比同周期的氧族元素和卤族元素弱 |
| C、原子半径比同周期的氧族元素、卤族元素小 |
| D、稳定性:NH3>PH3 |