题目内容
硝酸工业尾气中氮的氧化物(NO、NO2)是大气污染物,可用基于下列反应的方法治理:2NO2+2NaOH→NaNO3+NaNO2+H2O NO+NO2+2NaOH→2NaNO2+H2O;
(1)若在标准状况下有NO、NO2的混合物恰好与50mL 2.0mol?L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为多少?
(2)设NO、NO2的混合气体用NOx表示,用碱液吸收,生成硝酸钠及亚硝酸钠再结晶分离.
①试写出NOx与NaOH溶液反应的化学方程式:
②若生产每吨硝酸钠的成本为0.16万元,生产每吨亚 硝酸钠的成本为0.27万元.
目前市场出售价:硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元.则每处理22.4×109L(标准状况)含NOx(x≥1.5)0.1%(体积分数)的尾气,所得利润y(出售价减去成本价,单位:万元)与x的关系为 .
(3)根据(2)的计算结果,在以下坐标系中作出其示意图.

(1)若在标准状况下有NO、NO2的混合物恰好与50mL 2.0mol?L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为多少?
(2)设NO、NO2的混合气体用NOx表示,用碱液吸收,生成硝酸钠及亚硝酸钠再结晶分离.
①试写出NOx与NaOH溶液反应的化学方程式:
②若生产每吨硝酸钠的成本为0.16万元,生产每吨亚 硝酸钠的成本为0.27万元.
目前市场出售价:硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元.则每处理22.4×109L(标准状况)含NOx(x≥1.5)0.1%(体积分数)的尾气,所得利润y(出售价减去成本价,单位:万元)与x的关系为
(3)根据(2)的计算结果,在以下坐标系中作出其示意图.

考点:化学方程式的有关计算
专题:计算题
分析:(1)NO、NO2的物质的量分别为xmol、ymol,利用反应的化学方程式解答;
(2)①NOx与NaOH溶液反应生成亚硝酸钠、硝酸钠与水,钠原子与氮原子物质的量之比为1:1,利用待定系数法配平书写方程式;
②根据方程式计算生成亚硝酸钠、硝酸钠的质量,进而计算利润;
(3)根据(2)的计算结果可知,需在坐标系中作出y=1.01x-0.825示意图.
(2)①NOx与NaOH溶液反应生成亚硝酸钠、硝酸钠与水,钠原子与氮原子物质的量之比为1:1,利用待定系数法配平书写方程式;
②根据方程式计算生成亚硝酸钠、硝酸钠的质量,进而计算利润;
(3)根据(2)的计算结果可知,需在坐标系中作出y=1.01x-0.825示意图.
解答:
解:(1)NO、NO2的物质的量分别为xmol、ymol,则:
NO2+NO+2NaOH→2NaNO2+H2O
1 1 2
x x 2x
2NO2+2NaOH→NaNO2+NaNO3+H2O
2 1 1
(y-x) 0.5(y-x) 0.5(y-x)
所以[2x+0.5(y-x)]:0.5(y-x)=4:1,故x:y=3:7,
则NO的体积分数为
=0.3,
答:混合气体中NO气体的体积分数为0.3;
(2)①NOx与NaOH溶液反应生成亚硝酸钠、硝酸钠与水,令NOx、NaOH系数都为1,配平后方程式为2NOx+2NaOH=(2x-3)NaNO3+(5-2x)NaNO2+H2O,
故答案为:2NOx+2NaOH=(2x-3)NaNO3+(5-2x)NaNO2+H2O;
②2NOx+2NaOH=(2x-3)NaNO3 +(5-2x)NaNO2+H2O
44.8L 85(2x-3)g 69(5-2x)g
22.4×109L×0.1% 42.5(2x-3)×0.1%×109g 34.5(5-2x)×0.1%×109g
故y=
×(0.18-0.16)+
×(0.28-0.27)=1.01x-0.825
故答案为:y=1.01x-0.825;
(3)所得利润y与x的关系式为y=1.01x-0.825,为一次函数,因NOx(x≥1.5)当x=1.5时,y=0.69,当x=2.0时,y=1.195,所以该图为: ,
,
答:坐标系中作出其示意图为 .
.
NO2+NO+2NaOH→2NaNO2+H2O
1 1 2
x x 2x
2NO2+2NaOH→NaNO2+NaNO3+H2O
2 1 1
(y-x) 0.5(y-x) 0.5(y-x)
所以[2x+0.5(y-x)]:0.5(y-x)=4:1,故x:y=3:7,
则NO的体积分数为
| 3 |
| 3+7 |
答:混合气体中NO气体的体积分数为0.3;
(2)①NOx与NaOH溶液反应生成亚硝酸钠、硝酸钠与水,令NOx、NaOH系数都为1,配平后方程式为2NOx+2NaOH=(2x-3)NaNO3+(5-2x)NaNO2+H2O,
故答案为:2NOx+2NaOH=(2x-3)NaNO3+(5-2x)NaNO2+H2O;
②2NOx+2NaOH=(2x-3)NaNO3 +(5-2x)NaNO2+H2O
44.8L 85(2x-3)g 69(5-2x)g
22.4×109L×0.1% 42.5(2x-3)×0.1%×109g 34.5(5-2x)×0.1%×109g
故y=
| 42.5(2x-3)×0.1%×109 |
| 106 |
| 34.5(5-2x)×0.1%×109 |
| 106 |
故答案为:y=1.01x-0.825;
(3)所得利润y与x的关系式为y=1.01x-0.825,为一次函数,因NOx(x≥1.5)当x=1.5时,y=0.69,当x=2.0时,y=1.195,所以该图为:
 ,
,答:坐标系中作出其示意图为
 .
.
点评:本题考查混合物的有关计算,注意根据方程式进行计算,需要学生具备扎实的基础与利用信息、基础知识分析解决问题的能力,发现化学方程式中隐含的关系和规律是解题关键,难度中等.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,氧气和臭氧的混合物16g中约含有NA个氧原子 |
| B、标准状况下,11.2 L H2O2中含分子数为0.5NA |
| C、标准状况下,22.4 L H2中含中子数为2NA |
| D、1 L0.5mol/LNa2CO3溶液中含有的CO32-数目为0.5NA |
下列物质按照混合物、纯净物、强电解质、弱电解质、非电解质的顺序排列正确的一组是( )
| A、盐酸、胆矾、NH4Cl、CH3COOH、CO2 |
| B、干冰、氯水、HCl、HClO、CO |
| C、漂白粉、氯气、BaSO4、CO2、SO2 |
| D、硫酸、氨水、醋酸、乙醇、NO2 |
下列叙述正确的是( )
| A、氢氟酸不能保存在玻璃瓶内,也不和任何酸性氧化物反应 |
| B、实验室储存少量溴时,往往在液面上加少量水,防止溴被氧化 |
| C、氟化氢在空气中呈现白雾,这种白雾有剧毒 |
| D、碘化钾水溶液能使淀粉变蓝 |
有机化合物中的烯键跟臭氧(O3)反应,再在锌粉存在下水解,其结果是原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(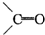 ),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
(CH3)2C═O+CH3CH═O分子式为C4H8的几种烯烃混合气体经O3氧化并在锌粉存在下水解后生成0.60mol酮和1.80mol醛(其中HCHO 0.90mol)原混合气体中,2-丁烯的体积分数为( )
 ),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3| O3 |
| Zn、H2O |
| A、0.25 | B、0.33 |
| C、0.40 | D、0.50 |
如图象纵坐标表示沉淀量,横坐标表示加入x的物质的量,下列实验内容与图象正确的组合是( )

①NaAlO2溶液中滴入HCl
②盐酸酸化的MgCl2、AlCl3溶液中滴入NaOH溶液
③NaOH溶液中滴入AlCl3溶液
④AlCl3溶液中滴入NH3?H2O.

①NaAlO2溶液中滴入HCl
②盐酸酸化的MgCl2、AlCl3溶液中滴入NaOH溶液
③NaOH溶液中滴入AlCl3溶液
④AlCl3溶液中滴入NH3?H2O.
| A、①a | B、②b | C、③c | D、④d |
下列叙述错误的是( )
| A、苯、乙烯都既能发生加成反应,也能发生氧化反应 |
| B、塑料、橡胶和合成纤维都属于有机高分子化合物 |
| C、糖类、脂肪和蛋白质在一定条件下都能发生水解反应 |
| D、分子式为C12H22O11的糖有蔗糖和麦芽糖,它们属于同分异构体 |
