题目内容
用NA表示阿伏加德罗常数,下列有关叙述正确的是( )
| A、2.24L CO2中含有的原子数为0.3NA |
| B、500mL 0.2mol/L的Fe2(SO4)3溶液中Fe3+总数为0.2NA |
| C、5.6g铁粉与硝酸完全反应失去的电子数一定为0.3NA |
| D、28g N2和CO的混合气体含有的原子总数为2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算二氧化碳的物质的量;
B.铁离子在溶液中部分水解,导致铁离子数目减少;
C.铁过量时,铁与硝酸反应生成亚铁离子,0.1mol铁完全反应失去0.2mol电子;
D.氮气和一氧化碳的摩尔质量为28g/mol,二者都是双原子分子,据此计算混合气体中含有的原子数.
B.铁离子在溶液中部分水解,导致铁离子数目减少;
C.铁过量时,铁与硝酸反应生成亚铁离子,0.1mol铁完全反应失去0.2mol电子;
D.氮气和一氧化碳的摩尔质量为28g/mol,二者都是双原子分子,据此计算混合气体中含有的原子数.
解答:
解:A.不是标况下,不能使用标况下的气体摩尔体积计算2.24L二氧化碳的物质的量,故A错误;
B.500mL 0.2mol/L的Fe2(SO4)3溶液中含有溶质硫酸铁0.1mol,由于铁离子部分水解,则溶液中Fe3+总数小于0.2NA,故B错误;
C.5.6g铁的物质的量为0.1mol,0.1mol铁与足量硝酸反应失去0.3mol电子,若铁粉过量,则反应生成亚铁离子,0.1mol铁完全反应失去0.2mol电子,故C错误;
D.28g氮气和一氧化碳的混合物中含有1mol混合气体,含有2mol原子,含有的原子总数为2NA,故D正确;
故选D.
B.500mL 0.2mol/L的Fe2(SO4)3溶液中含有溶质硫酸铁0.1mol,由于铁离子部分水解,则溶液中Fe3+总数小于0.2NA,故B错误;
C.5.6g铁的物质的量为0.1mol,0.1mol铁与足量硝酸反应失去0.3mol电子,若铁粉过量,则反应生成亚铁离子,0.1mol铁完全反应失去0.2mol电子,故C错误;
D.28g氮气和一氧化碳的混合物中含有1mol混合气体,含有2mol原子,含有的原子总数为2NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项C为易错点,注意反应物铁粉的过量情况.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
实验室需配制一种只含有四种离子(除H+和OH-外)的混合溶液,且在该混合溶液中四种离子的物质的量浓度均为0.1mol/L,以下各组能达到此目的是( )
| A、K+、SO42-、I-、NO3- |
| B、Cu2+、Na+、Cl-、S2- |
| C、Na+、K+、HCO3-、NO3- |
| D、K+、Ba2+、CH3COO-、Br- |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,氧气和臭氧的混合物16g中约含有NA个氧原子 |
| B、标准状况下,11.2 L H2O2中含分子数为0.5NA |
| C、标准状况下,22.4 L H2中含中子数为2NA |
| D、1 L0.5mol/LNa2CO3溶液中含有的CO32-数目为0.5NA |
下列反应中,属于吸热反应的是( )
| A、食物的腐败 |
| B、铝与稀盐酸反应 |
| C、二氧化碳与碳反应生成一氧化碳 |
| D、甲烷在氧气中的燃烧 |
下列方程式书写正确的是( )
| A、NaHCO3在水溶液中的电离方程式:NaHCO3?Na++HCO3- |
| B、H2SO3的电离方程式H2SO3?2H++SO32- |
| C、CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
| D、HS-的水解方程式:HS-+H2O?H2S+OH- |
下列离子方程式正确的是( )
A、在稀氨水中通入过量CO2:NH3?H2O+CO2=NH
| ||||
| B、向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | ||||
| C、向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H2O | ||||
D、NH4HSO4溶液中加入足量Ba(OH)2溶液:H++SO
|
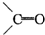 ),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3