题目内容
在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g);△H<0.
回答下列问题: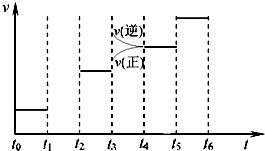
(1)在一定温度下,向一容积为2L的密闭容器中通入0.3molN2和0.9molH2,2min达到平衡时,C(N2)为0.1mol/L,则H2的转化率为 ,用H2浓度变化表示的平均反应速率为 该温度下的平衡常数K= .
(2)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态(1)相同,则起始时n(NH3)的取值范围为 .
(3)若图中t1时刻将容器体积变为原来的1/2倍,当t2时刻再次达到平衡时N2的浓度为原平衡的1.9倍,则平衡 (“正移”“逆移”“不移动”).
①t3、t5时刻体系中所改变的某一条件分别是: 、 ;其中表示平衡混合物中NH3的含量最高的时间段是 .
回答下列问题:

(1)在一定温度下,向一容积为2L的密闭容器中通入0.3molN2和0.9molH2,2min达到平衡时,C(N2)为0.1mol/L,则H2的转化率为
(2)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态(1)相同,则起始时n(NH3)的取值范围为
(3)若图中t1时刻将容器体积变为原来的1/2倍,当t2时刻再次达到平衡时N2的浓度为原平衡的1.9倍,则平衡
①t3、t5时刻体系中所改变的某一条件分别是:
考点:化学反应速率与化学平衡图象的综合应用
专题:化学平衡专题
分析:(1)转化率为已转化浓度与起始浓度的百分比;利用2min内氢气浓度的变化计算;利用化学平衡常数计算得出;
(2)反应开始时向逆反应方向进行,即n(NH3)大于平衡(1)平衡时NH3的物质的量;达到平衡后各气体的物质的量与平衡状态(1)相同,即与平衡(1)等效,则加入的NH3物质的量最大时,即为不加人N2和H2时的n(NH3);
(3)容器体积变为原来的1/2倍,若平衡不移动,则再次达到平衡时N2的浓度为原平衡的2倍,据此判断;
①t3时刻正逆反应速率均增大,且逆反应速率大于正反应速率,据此判断;t5时刻,正逆反应速率均增大相同的倍数,为催化剂的影响;正反应进行到最大程度时,混合物中NH3的含量最高.
(2)反应开始时向逆反应方向进行,即n(NH3)大于平衡(1)平衡时NH3的物质的量;达到平衡后各气体的物质的量与平衡状态(1)相同,即与平衡(1)等效,则加入的NH3物质的量最大时,即为不加人N2和H2时的n(NH3);
(3)容器体积变为原来的1/2倍,若平衡不移动,则再次达到平衡时N2的浓度为原平衡的2倍,据此判断;
①t3时刻正逆反应速率均增大,且逆反应速率大于正反应速率,据此判断;t5时刻,正逆反应速率均增大相同的倍数,为催化剂的影响;正反应进行到最大程度时,混合物中NH3的含量最高.
解答:
解:(1)N2的起始浓度为:
=0.15mol/L,平衡时浓度为0.1mol/L,则N2转化浓度为:0.15mol/L-0.1mol/L=0.05mol/L,则H2的转化浓度为:3×0.05mol/L=0.15mol/L,H2的起始浓度为:
=0.45mol/L,H2转化率为:
×100%=33.3%;2min内H2浓度变化了0.15mol/L,平均反应速率为
=0.075mol?L-1?min-1;生成氨气的浓度即为氨气平衡时浓度,浓度为:2×0.05mol/L=0.1mol/L,H2的平衡时浓度为:0.45mol/L-0.15mol/L=0.3mol/L,化学平衡常数表达式为:K=
=
=3.7;
故答案为:33.3%,0.075mol?L-1?min-1,3.7;
(2)反应开始时向逆反应方向进行,即n(NH3)大于平衡(1)平衡时NH3的物质的量,即0.2 mol<n(NH3);达到平衡后各气体的物质的量与平衡状态(1)相同,即与平衡(1)等效,由于反应前后计量数不同,则加入的NH3物质的量全部转化为N2和H2时,与平衡(1)相同,故当N2和H2物质的量为零时,加入的n(NH3)最大,为0.3mol×2=0.6mol,即n(NH3)的取值范围为:0.2 mol<n(NH3)≤0.6 mol;故答案为:0.2 mol<n(NH3)≤0.6 mol;
(3)容器体积变为原来的
倍,若平衡不移动,则再次达到平衡时N2的浓度为原平衡的2倍,而现在为1.9倍,则说明化学平衡右移;故答案为:正移;
①t3时刻正逆反应速率均增大,且逆反应速率大于正反应速率,由于反应△H<0,正反应放热,升高温度向逆反应方向移动,则t3时刻改变条件为升高温度;t5时刻,正逆反应速率均增大相同的倍数,为催化剂的影响;正反应进行到最大程度时,混合物中NH3的含量最高,由于t3→t4,平衡向逆反应方向移动,则时刻t2→t3,NH3的含量最高;
故答案为:升温、加催化剂、t2→t3.
| 0.3mol |
| 2L |
| 0.9mol |
| 2L |
| 0.15mol/L |
| 0.45mol/L |
| 0.15mol/L |
| 2min |
| [NH3]2 |
| [N2]?[H2]3 |
| 0.12 |
| 0.1×0.33 |
故答案为:33.3%,0.075mol?L-1?min-1,3.7;
(2)反应开始时向逆反应方向进行,即n(NH3)大于平衡(1)平衡时NH3的物质的量,即0.2 mol<n(NH3);达到平衡后各气体的物质的量与平衡状态(1)相同,即与平衡(1)等效,由于反应前后计量数不同,则加入的NH3物质的量全部转化为N2和H2时,与平衡(1)相同,故当N2和H2物质的量为零时,加入的n(NH3)最大,为0.3mol×2=0.6mol,即n(NH3)的取值范围为:0.2 mol<n(NH3)≤0.6 mol;故答案为:0.2 mol<n(NH3)≤0.6 mol;
(3)容器体积变为原来的
| 1 |
| 2 |
①t3时刻正逆反应速率均增大,且逆反应速率大于正反应速率,由于反应△H<0,正反应放热,升高温度向逆反应方向移动,则t3时刻改变条件为升高温度;t5时刻,正逆反应速率均增大相同的倍数,为催化剂的影响;正反应进行到最大程度时,混合物中NH3的含量最高,由于t3→t4,平衡向逆反应方向移动,则时刻t2→t3,NH3的含量最高;
故答案为:升温、加催化剂、t2→t3.
点评:本题考查化学平衡的有关计算,题目难度不大,注意把握有关计算公式的运用和对概念的理解.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
下列离子方程式正确的是( )
A、在稀氨水中通入过量CO2:NH3?H2O+CO2=NH
| ||||
| B、向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | ||||
| C、向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H2O | ||||
D、NH4HSO4溶液中加入足量Ba(OH)2溶液:H++SO
|
有机化合物中的烯键跟臭氧(O3)反应,再在锌粉存在下水解,其结果是原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(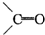 ),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
(CH3)2C═O+CH3CH═O分子式为C4H8的几种烯烃混合气体经O3氧化并在锌粉存在下水解后生成0.60mol酮和1.80mol醛(其中HCHO 0.90mol)原混合气体中,2-丁烯的体积分数为( )
 ),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3| O3 |
| Zn、H2O |
| A、0.25 | B、0.33 |
| C、0.40 | D、0.50 |
下列叙述错误的是( )
| A、苯、乙烯都既能发生加成反应,也能发生氧化反应 |
| B、塑料、橡胶和合成纤维都属于有机高分子化合物 |
| C、糖类、脂肪和蛋白质在一定条件下都能发生水解反应 |
| D、分子式为C12H22O11的糖有蔗糖和麦芽糖,它们属于同分异构体 |
下列关于氮族元素的说法中不正确的是( )
| A、原子的最外层均有5个电子,最高价均为+5价 |
| B、非金属性比同周期的氧族元素和卤族元素弱 |
| C、原子半径比同周期的氧族元素、卤族元素小 |
| D、稳定性:NH3>PH3 |