题目内容
12.研究硫元素及其化合物的性质具有重要意义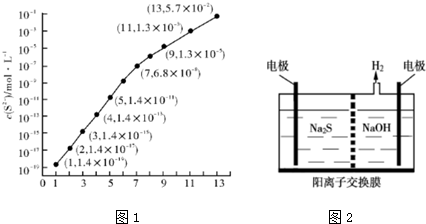
(1)25℃,在0.10mol•L-1HA溶液中,通入HCl气体或加入Na〇H固体以调节 溶液PH,溶液pH与c(S2-)关系如图1(忽略溶液体积的变化、H2S的挥发).
①pH=11 时,溶液中的 c(H2S)+c(HS-)=0.0987 mol•L-1.(保留3位有效数字)
②某溶液含0.010mol•L-1 Fe2+、未知浓度的Mn2+和0.10mol•L-1H2S,当溶液pH=2 时,Fe2+开始沉淀;当Mn2+开始沉淀时,溶液中$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=2.0×106.
[已知:Ksp(FeS)=1.4X10-19,Ksp(MnS)=2.8×10-13]
(2)硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.其中一种是将烧碱吸收H2S后的溶液加入到如图2所示的电解池 的阳极区进行电解.请写出阳极的电极反应式S2--2e-═S,同时阳极区还发生(n-1)S+S2-═Sn2-.电解后阳极区的溶液用稀硫酸酸化,产生淡黄色浑浊,其离子方程式为Sn2-+2H+=(n-1)S↓+H2S↑.
(3)25℃,两种酸的电离平衡常数如表.
| Ka | Ka2 | |
| H2S03 | 1.3×10-2 | 6.3×10-8 |
| H2C03 | 4.2×10-7 | 5.6×10-11 |
分析 (1)①pH=11时,c(S2-)=1.3×10-3mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②当Qc=Ksp(FeS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH;当Qc=Ksp(MnS)时开始沉淀,溶液中$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$$\frac{c({S}^{2-})}{c({S}^{2-})}$=$\frac{Ksp(MnS)}{Ksp(FeS)}$;
(2)由图可知,右侧H得到电子生成氢气,则右侧为阴极,阳极上Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应,同时S元素得电子生成H2S;
(3)由表可知H2SO3的二级电离小于H2CO3的一级电离,则酸性强弱H2SO3>H2CO3>HSO3-,据此书写反应的主要离子方程式.
解答 解:(1)①pH=13时,c(S2-)=1.3×10-3mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-1.3×10-3=0.0987mol/L,故答案为:0.0987;
②当Qc=Ksp(FeS)时开始沉淀c(S2-)=$\frac{1.4×1{0}^{-19}}{0.010mol/L}$=1.4×10-17mol/L,图象中分析可知此时PH=2,
当Qc=Ksp(MnS)时开始沉淀,溶液中$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$$\frac{c({S}^{2-})}{c({S}^{2-})}$=$\frac{Ksp(MnS)}{Ksp(FeS)}$=$\frac{2.8×1{0}^{-13}}{1.4×1{0}^{-19}}$=2.0×106,
故答案为:2;2.0×106;
(2)①阳极上硫离子放电,电极反应式为S2--2e-═S,阴极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,
故答案为:S2--2e-═S;
②电解后阳极区离子为Sn2-,酸性条件下,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素得电子生成H2S,反应方程式为Sn2-+2H+=(n-1)S↓+H2S↑,故答案为:Sn2-+2H+=(n-1)S↓+H2S↑;
(3)由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为:SO2+HCO3-=HSO3-+CO2↑,而不是为SO2+2HCO3-=SO32-+2CO2↑+H2O.
故答案为:SO2+HCO3-=HSO3-+CO2↑.
点评 本题考查了离子浓度大小比较、难溶物溶度积的计算、电解池电极反应书写、电离平衡常数大小比较和应用,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握难溶物溶度积的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | 纤维素是白色无臭无味的物质 | |
| B. | 纤维素是不显还原性的物质 | |
| C. | 纤维素不溶于水和一般的有机溶剂 | |
| D. | 纤维素可以发生水解反应,水解的最终产物是麦芽糖 |
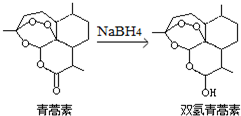 我国科学家屠呦呦获得2015年诺贝尔生理学或医学奖.她研究的青蒿素、双氢青蒿素在寄生虫疾病治疗方面取得了伟大成就.下列有关说法正确的是( )
我国科学家屠呦呦获得2015年诺贝尔生理学或医学奖.她研究的青蒿素、双氢青蒿素在寄生虫疾病治疗方面取得了伟大成就.下列有关说法正确的是( )| A. | 青蒿素易溶于水 | |
| B. | 青蒿素可与NaOH溶液反应 | |
| C. | 青蒿素转化为双氢青蒿素是氧化反应 | |
| D. | 青蒿素有11种一氯代物 |
| A. | 第三周期 | B. | 第二周期 | C. | ⅤA族 | D. | ⅤⅠA族 |
| A. | “可燃冰”有可能成为人类未来的重要能源 | |
| B. | “可燃冰”是一种比较洁净的能源 | |
| C. | “可燃冰”提供了水可能变成油的例证 | |
| D. | “可燃冰”的主要可燃成分是甲烷 |
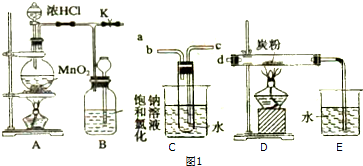
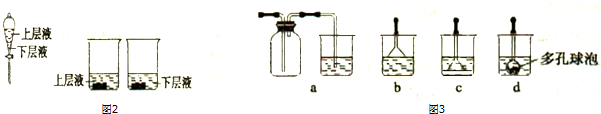
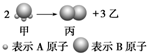 如图所示:已知甲、乙、丙常温下都为气体.
如图所示:已知甲、乙、丙常温下都为气体.