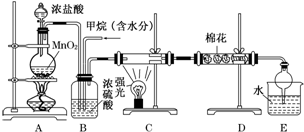
题目内容
4.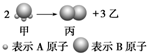 如图所示:已知甲、乙、丙常温下都为气体.
如图所示:已知甲、乙、丙常温下都为气体.(1)乙气体的分子式A2.(用A、B表示,A、B可以选择性使用)
(2)若测得生成物的混合气体对氢气的相对密度为d,则甲的摩尔质量为4d g/mol(用d表示)
(3)标准状况下,11.2L甲气体溶于500mL水中,所得溶液的密度为ρg/cm3,则所得溶液中甲的物质的量浓度为$\frac{500ρ}{(2d+500)}$mol/L(用d、ρ表示)(甲的摩尔质量用(2)中的数据).
分析 (1)根据原子守恒确定乙的分子式;
(2)相同条件下,气体密度之比等于其摩尔质量之比,进而计算生成物的平均摩尔质量,假设甲为2mol,则生成的混合物为4mol,根据m=nM计算生成物的质量,结合质量守恒定律可知甲的质量,再根据M=$\frac{m}{n}$计算甲的摩尔质量;
(3)根据n=$\frac{V}{{V}_{m}}$计算甲的物质的量,根据m=nM计算甲的质量,溶液质量=甲的质量+水的质量,再根据V=$\frac{m}{ρ}$计算溶液体积,根据c=$\frac{n}{V}$计算甲的物质的量浓度.
解答 解:(1)根据原子守恒,可知乙的分子式为:A2,
故答案为:A2;
(2)测得生成物的混合气体对氢气的相对密度为d,则其平均摩尔质量为2d g/mol,假设甲为2mol,则生成的混合物为4mol,根据质量守恒定律可知甲的质量为4mol×2d g/mol=8d g,故甲的摩尔质量为$\frac{8dg}{2mol}$=4d g/mol,
故答案为:4d g/mol;
(3)标况下,11.2L 甲的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,则甲的质量为0.5mol×4d g/mol=2d g,溶液质量=(2d+500)g,则溶液体积为$\frac{(2d+500)g}{1000ρg/L}$=$\frac{2d+500}{1000ρ}$L,甲的物质的量浓度为0.5mol÷$\frac{2d+500}{1000ρ}$L=$\frac{500ρ}{(2d+500)}$mol/L,
故答案为:$\frac{500ρ}{(2d+500)}$mol/L.
点评 本题考查化学方程式计算、物质的量浓度计算等,(3)中计算溶液体积是关键,注意理解物质的量浓度定义式.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | NO和NO2的排放能引起酸雨,还可能引起光化学烟雾 | |
| B. | 太阳能电池与普通电池相同,都可以把化学能转化为电能 | |
| C. | 含有重金属盐的皮革废料经水解制成的粉状物可掺入奶粉中 | |
| D. | 普通玻璃可以制钢化玻璃,也可以制光导纤维 |
| A. | 30mL | B. | 40mL | C. | 50mL | D. | 60mL |
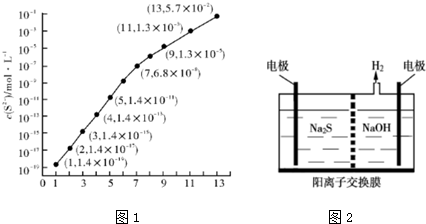
(1)25℃,在0.10mol•L-1HA溶液中,通入HCl气体或加入Na〇H固体以调节 溶液PH,溶液pH与c(S2-)关系如图1(忽略溶液体积的变化、H2S的挥发).
①pH=11 时,溶液中的 c(H2S)+c(HS-)=0.0987 mol•L-1.(保留3位有效数字)
②某溶液含0.010mol•L-1 Fe2+、未知浓度的Mn2+和0.10mol•L-1H2S,当溶液pH=2 时,Fe2+开始沉淀;当Mn2+开始沉淀时,溶液中$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=2.0×106.
[已知:Ksp(FeS)=1.4X10-19,Ksp(MnS)=2.8×10-13]
(2)硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.其中一种是将烧碱吸收H2S后的溶液加入到如图2所示的电解池 的阳极区进行电解.请写出阳极的电极反应式S2--2e-═S,同时阳极区还发生(n-1)S+S2-═Sn2-.电解后阳极区的溶液用稀硫酸酸化,产生淡黄色浑浊,其离子方程式为Sn2-+2H+=(n-1)S↓+H2S↑.
(3)25℃,两种酸的电离平衡常数如表.
| Ka | Ka2 | |
| H2S03 | 1.3×10-2 | 6.3×10-8 |
| H2C03 | 4.2×10-7 | 5.6×10-11 |
| A. | H2S | B. | NO2 | C. | NH3 | D. | HBr |
| A. | 用分液的方法分离煤油和NaCl溶液的混合物 | |
| B. | 用结晶法提纯NaCl和KNO3混合物中的KNO3 | |
| C. | 用蒸馏法分离乙醇和水的混合物 | |
| D. | 用加热法分离碘和氯化铵的混合物(提示:碘易升华,氯化铵受热易分解,冷却后它们又都重新生成原固体) |
| A. | 向某溶液中滴加氯水,再滴加KSCN溶液,若溶液变成血红色,则原溶液中一定有Fe2+ | |
| B. | 钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,进行灼烧,直接观察火焰颜色 | |
| C. | 向某溶液中滴加氯化钡溶液,产生白色沉淀,再滴加足量稀硝酸,依然有白色固体,说明原溶液含有SO42- | |
| D. | 向某黄色溶液中加入淀粉溶液,若溶液变蓝色,则原溶液中含有I2 |