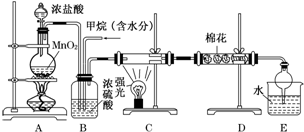
题目内容
1.某元素R的原子核外电子数等于核内中子数.取该元素单质2.8g与足量O2化合,可得6g氧化物RO2,则该元素在周期表中的位置是( )| A. | 第三周期 | B. | 第二周期 | C. | ⅤA族 | D. | ⅤⅠA族 |
分析 根据单质和氧气的反应确定单质的相对分子质量进而确定元素原子的相对原子质量,相对原子质量在数值上等于质量数,据A=Z+N来确定质子数,确定元素原子的核外电子排布以确定该元素在周期表中的位置.
解答 解:元素单质2.8克与氧气充分作用,可得到6克化合物RO2,据原子守恒,R~RO2,设元素的相对原子质量为M,故有:$\frac{2.8g}{Mg/mol}$=$\frac{6g}{(32+M)g/mol}$,解得:M=28核外电子数等于核内中子数等于14,故该元素为硅,位于第三周期,第ⅣA族.
故选:A.
点评 本题考查学生相对原子质量的计算和原子结构决定元素的位置知识,难度不大.

练习册系列答案
相关题目
2.某有机物a的分子式和己烷相同,且主链上有4个碳原子,则下列关于a的观点正确的是( )
| A. | a的一氯代物可能有三种 | |
| B. | a分子中可能有三个甲基 | |
| C. | a能与溴的四氯化碳溶液发生取代反应 | |
| D. | a的分子式为C6H10 |
12.研究硫元素及其化合物的性质具有重要意义
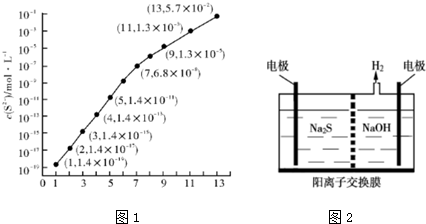
(1)25℃,在0.10mol•L-1HA溶液中,通入HCl气体或加入Na〇H固体以调节 溶液PH,溶液pH与c(S2-)关系如图1(忽略溶液体积的变化、H2S的挥发).
①pH=11 时,溶液中的 c(H2S)+c(HS-)=0.0987 mol•L-1.(保留3位有效数字)
②某溶液含0.010mol•L-1 Fe2+、未知浓度的Mn2+和0.10mol•L-1H2S,当溶液pH=2 时,Fe2+开始沉淀;当Mn2+开始沉淀时,溶液中$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=2.0×106.
[已知:Ksp(FeS)=1.4X10-19,Ksp(MnS)=2.8×10-13]
(2)硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.其中一种是将烧碱吸收H2S后的溶液加入到如图2所示的电解池 的阳极区进行电解.请写出阳极的电极反应式S2--2e-═S,同时阳极区还发生(n-1)S+S2-═Sn2-.电解后阳极区的溶液用稀硫酸酸化,产生淡黄色浑浊,其离子方程式为Sn2-+2H+=(n-1)S↓+H2S↑.
(3)25℃,两种酸的电离平衡常数如表.
实验室常用饱和NaHC03溶液除去C02中少量的S02,请写出S02和NaHC03溶液反应的主要离子方程式SO2+HCO3-=HSO3-+CO2↑.

(1)25℃,在0.10mol•L-1HA溶液中,通入HCl气体或加入Na〇H固体以调节 溶液PH,溶液pH与c(S2-)关系如图1(忽略溶液体积的变化、H2S的挥发).
①pH=11 时,溶液中的 c(H2S)+c(HS-)=0.0987 mol•L-1.(保留3位有效数字)
②某溶液含0.010mol•L-1 Fe2+、未知浓度的Mn2+和0.10mol•L-1H2S,当溶液pH=2 时,Fe2+开始沉淀;当Mn2+开始沉淀时,溶液中$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=2.0×106.
[已知:Ksp(FeS)=1.4X10-19,Ksp(MnS)=2.8×10-13]
(2)硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.其中一种是将烧碱吸收H2S后的溶液加入到如图2所示的电解池 的阳极区进行电解.请写出阳极的电极反应式S2--2e-═S,同时阳极区还发生(n-1)S+S2-═Sn2-.电解后阳极区的溶液用稀硫酸酸化,产生淡黄色浑浊,其离子方程式为Sn2-+2H+=(n-1)S↓+H2S↑.
(3)25℃,两种酸的电离平衡常数如表.
| Ka | Ka2 | |
| H2S03 | 1.3×10-2 | 6.3×10-8 |
| H2C03 | 4.2×10-7 | 5.6×10-11 |
9.下列各组混合物的分离或提纯方法不正确的是( )
| A. | 用分液的方法分离煤油和NaCl溶液的混合物 | |
| B. | 用结晶法提纯NaCl和KNO3混合物中的KNO3 | |
| C. | 用蒸馏法分离乙醇和水的混合物 | |
| D. | 用加热法分离碘和氯化铵的混合物(提示:碘易升华,氯化铵受热易分解,冷却后它们又都重新生成原固体) |
6.合理利用某些盐能水解的性质,能解决许多生产、生活中的问题,下列叙述的事实与盐水解的性质无关的是( )
| A. | 碳酸钠溶液呈碱性,具有较强的去油污能力 | |
| B. | Al2(SO4)3与NaHCO3溶液可用作消防器材中的灭火剂 | |
| C. | NaCl可用作防腐剂和调味剂 | |
| D. | 焊接时用NH4Cl溶液除锈 |
13.下列关于物质或离子检验的叙述正确的是( )
| A. | 向某溶液中滴加氯水,再滴加KSCN溶液,若溶液变成血红色,则原溶液中一定有Fe2+ | |
| B. | 钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,进行灼烧,直接观察火焰颜色 | |
| C. | 向某溶液中滴加氯化钡溶液,产生白色沉淀,再滴加足量稀硝酸,依然有白色固体,说明原溶液含有SO42- | |
| D. | 向某黄色溶液中加入淀粉溶液,若溶液变蓝色,则原溶液中含有I2 |
10.某铝土矿样品中含有Al2O3、Fe2O3和SiO2,进行一系列操作将它们分离:加入试剂、过滤、洗涤、灼烧等.依次加入的一组试剂是( )
| A. | NaOH溶液、盐酸、氨气 | B. | 硫酸、NaOH溶液、盐酸 | ||
| C. | NaOH溶液、盐酸、CO2 | D. | 水、盐酸、NaOH溶液 |