题目内容
13.如图1是某学习小组设计制取氯气并以氣气为反应物进行特定反应的装置.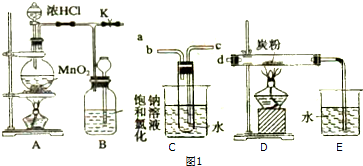
(1)要将C装置接入B和D之间,正确的接法是a→c→b→d.
(2)实验开始先点燃A处的酒精灯,打开夹子K,让Cl2充满整个装置,再点燃D处的酒精灯.Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式:2Cl2+C+2H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4HCl+CO2.
为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供D中反应需要.
(3)D处反应完毕后,关闭夹子K,移去两个酒精灯,由于余热的作用,A处仍有少量 Cl2产生,此时B中的现象是瓶中液面下降,长颈漏斗内液面上升;B的作用是贮存少量Cl2,避免Cl2对环境造成污染.
(4)用量筒量取20mLE中溶液,倒入己检查完气密性良好的分液漏斗中.然后再注入 l0mLCCl4,盖好玻璃塞(如图2),振荡,静罝于铁架台上,等分层后取上层液和下层液,呈黄绿色的是下层液(填“上层液”或“下层液”),再装入如图2所示的烧杯中,各放入一片干燥的有色布条,能使有色布条褪色的是上层液 (填“上层液”或“下层液”).
(5)在装置中E处需要改进,应选用下列图3装置中的b(填代号).
分析 (1)气体通过盛有水的试管时应长进短出;可利用微热或加入水的方式形成压强差,观察长颈漏斗液面的变化来判断气密性;
(2)根据反应物和生成物,结合质量守恒定律书写化学方程式;利用浓硫酸溶于水放热的性质分析;
(3)关闭旋塞K,B中的气体逐渐增多,压强增大,B能贮存气体;
(4)应用相似相溶原理,实际上是萃取知识的应用和考查,CCl4密度大于水,氯气和水反应生成次氯酸具有漂白性;
(5)反应生成易溶于水的氯化氢气体装置E易发生倒吸;
解答 解:(1)由装置图判断判断,气体由B流经C进入到D中反应,气体通过盛有水的试管时应长进短出,否则不能通过C装置,
故答案为:c,b;
(2)由题意知反应为Cl2、C、H2O,生成物为HCl和CO2,则反应的化学方程式为2Cl2+C+2H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4HCl+CO2,C为提供水蒸气的装置,加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,
故答案为:2Cl2+C+2H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4HCl+CO2;加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供D中反应需要;
(3)关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,B中的气体逐渐增多,压强增大,则导致瓶中液面下降,长颈漏斗内液面上升,氯气有毒,不能直接排放到空气中,B具有贮存少量氯气,并能防止空气污染,
故答案为:瓶中液面下降,长颈漏斗内液面上升;贮存少量Cl2,避免Cl2对环境造成污染;
(4)用量筒量取20 mL E中溶液,倒入已检查完气密性良好的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上,等分层后取上层液和下层液,四氯化碳比水重,氯气在四氯化碳中的溶解性大于水中,所以呈黄绿色的是下层液,上层也中含有氯气和水反应生成的次氯酸具有漂白性,能使有色布条褪色,
故答案为:下层液,上层液;
(5)反应生成易溶于水的氯化氢气体在装置中E处需要改进,防止液体倒吸,
a.液体倒吸会进入装置D的玻璃管炸裂玻璃管,故a错误;
b.倒扣的漏斗会增大与溶液接触面积,防止倒吸,故b错误;
c.和导气管直接插入溶液一样,能发生倒吸,故c错误;
d.多空球泡增大气体与溶液接触面积,但不能防止倒吸,故d错误;
应选用下列图3装置中的b,
故答案为:b.
点评 本题考查氯气的制备和性质实验,题目难度中等,注意实验基本操作和物质性质的理解应用.掌握基础是解题关键.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用分液的方法分离汽油和煤油 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体混合物 | |
| D. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
| A. | 氢氧化钡晶体和氯化铵晶体的反应 | |
| B. |  能量变化如图所示的反应 | |
| C. | 燃烧反应和中和反应 | |
| D. | 化学键断裂吸收的热量比化学键生成放出的热量多的反应 |
| A. | FeSO4酸性溶液暴露在空气中:2Fe2++O2+4H+=2Fe3++2H2O | |
| B. | MgSO4溶液滴入到Ba(OH)2溶液中:SO42-+Ba2+=BaSO4↓ | |
| C. | 向NaAlO2溶液中通入足量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- | |
| D. | FeCl3溶液中加入少量NaHS溶液:Fe3++3HS-+3H2O=Fe(OH)3↓+3H2S↑ |
| A. | NO和NO2的排放能引起酸雨,还可能引起光化学烟雾 | |
| B. | 太阳能电池与普通电池相同,都可以把化学能转化为电能 | |
| C. | 含有重金属盐的皮革废料经水解制成的粉状物可掺入奶粉中 | |
| D. | 普通玻璃可以制钢化玻璃,也可以制光导纤维 |
| A. | a的一氯代物可能有三种 | |
| B. | a分子中可能有三个甲基 | |
| C. | a能与溴的四氯化碳溶液发生取代反应 | |
| D. | a的分子式为C6H10 |
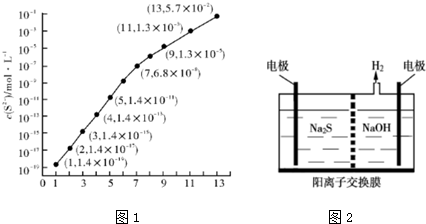
(1)25℃,在0.10mol•L-1HA溶液中,通入HCl气体或加入Na〇H固体以调节 溶液PH,溶液pH与c(S2-)关系如图1(忽略溶液体积的变化、H2S的挥发).
①pH=11 时,溶液中的 c(H2S)+c(HS-)=0.0987 mol•L-1.(保留3位有效数字)
②某溶液含0.010mol•L-1 Fe2+、未知浓度的Mn2+和0.10mol•L-1H2S,当溶液pH=2 时,Fe2+开始沉淀;当Mn2+开始沉淀时,溶液中$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=2.0×106.
[已知:Ksp(FeS)=1.4X10-19,Ksp(MnS)=2.8×10-13]
(2)硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.其中一种是将烧碱吸收H2S后的溶液加入到如图2所示的电解池 的阳极区进行电解.请写出阳极的电极反应式S2--2e-═S,同时阳极区还发生(n-1)S+S2-═Sn2-.电解后阳极区的溶液用稀硫酸酸化,产生淡黄色浑浊,其离子方程式为Sn2-+2H+=(n-1)S↓+H2S↑.
(3)25℃,两种酸的电离平衡常数如表.
| Ka | Ka2 | |
| H2S03 | 1.3×10-2 | 6.3×10-8 |
| H2C03 | 4.2×10-7 | 5.6×10-11 |
