题目内容
8.有a、b、c、d四个金属电极,G为电流计,有关的反应装置及部分反应现象记录如下:| 实验 装置 |  |  |  |  |
| 部分实 验现象 | a极质量减小 b极质量增加 | 溶液中的SO42--向b极移动 | d极溶解c极 有气体产生 | 电子从d极 流向a极 |
| A. | d>a>b>c | B. | a>b>c>d | C. | b>c>d>a | D. | a>b>d>c |
分析 形成原电池时,活泼金属作负极,不活泼金属作正极,负极逐渐溶解,正极上有气泡生成或有金属析出,电子从负极经外电路流向正极,溶液中阴离子向负极移动,据此来回答判断.
解答 解:a极质量减小b极质量增加,则a为负极,b为正极,所以金属的活动性顺序a>b;
溶液中的SO42-向b极移动,则b为负极,c为正极,所以金属的活动性顺序b>c;
d极溶解,所以d是负极,c极有气体产生,所以c是正极,所以金属的活动性顺序d>c;
电子从d极流向a极,d极为负极,a极为正极,所以金属的活动性顺序d>a;
所以这四种金属的活动性顺序d>a>b>c.
故选A.
点评 本题主要考查了金属的活动性强弱比较,侧重于原电池原理的应用考查,注意原电池中活泼性强的做负极,明确原电池中正负极的判断方法是解题的关键,题目难度不大.

练习册系列答案
相关题目
18.化学与社会、生活密切相关.对下列现象或事实的解释不正确的是( )
| 选项 | 现象或事实 | 解释或对应的离子方程式 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 酸雨样品在空气中放置pH减小 | 亚硫酸被氧化为硫酸 2H2SO3+O2=2H2SO4 |
| C | “84”消毒液具有漂白性 | ClO-+CO2+H2O=HClO+HCO3- |
| D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体可以完全分解成为气体而除去 |
| A. | A | B. | B | C. | C | D. | D |
19.已知:氯化银、溴化银、硫化银的Ksp分别为1.56×10-10、7.7×10-13、6.3×10-50,某溶液中含有浓度均为 0.01mol/L 的Cl-、Br-、S2-,向该溶液中逐滴滴加0.01mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序是( )
| A. | Cl-、Br-、S2- | B. | Br-、Cl-、S2- | C. | S2-、Br-、Cl- | D. | Br-、S2-、Cl- |
16.某课外实验小组设计的下列实验不合理的是( )


| A. | 图1:制备并观察氢氧化亚铁 | B. | 图2:证明过氧化钠与水反应放热 | ||
| C. | 图3:收集二氧化氮气体 | D. | 图4:制备氨气 |
20.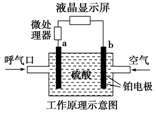 酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )
酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )
 酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )
酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )| A. | b为正极,电极反应式为:O2+4H++4e-═2H2O | |
| B. | 电解质溶液中的H+移向a电极 | |
| C. | 若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 | |
| D. | 呼出气体中酒精含量越高,微处理器中通过的电流越小 |
17.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol NaHCO3与足量盐酸反应放出CO2气体的体积为22.4L | |
| B. | 1 mol Al3+离子含有的核外电子数为3NA | |
| C. | O2和O3的混合气体,质量为48g,所含氧原子数为3NA | |
| D. | 高温下,0.2mol Fe与足量水蒸气反应,生成的H2的分子数目为0.3NA |
10.已知:Ag2SO4微溶于水,可溶于硝酸.溶液X中可能含有Na+、Ca2+、Fe2+、Cl-、Br-、CO32-、SiO32-、SO42-中的几种离子.为了确定其组成,某同学进行了如图实验:下列说法正确的是( )


| A. | 溶液X中一定含有Na+、Cl-和SiO32- | |
| B. | 溶液X中一定不含Ca2+、Br- | |
| C. | 为确定溶液X中是否含有SO42-,可取溶液2,加入BaCl2溶液 | |
| D. | 在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色 |
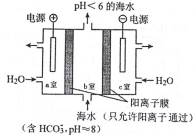 利用如图所示装置从海水中提取CO2,也有利于减少温室气体含量.
利用如图所示装置从海水中提取CO2,也有利于减少温室气体含量.