题目内容
16.某课外实验小组设计的下列实验不合理的是( )
| A. | 图1:制备并观察氢氧化亚铁 | B. | 图2:证明过氧化钠与水反应放热 | ||
| C. | 图3:收集二氧化氮气体 | D. | 图4:制备氨气 |
分析 A.Fe与稀硫酸反应生成氢气,将装置中空气排出,关闭止水夹,利用氢气将硫酸亚铁压入含NaOH的试管中反应生成氢氧化亚铁;
B.过氧化钠与水反应生成氧气,且放热,脱脂棉燃烧;
C.Cu与浓硝酸反应生成二氧化氮,二氧化氮与水反应;
D.浓氨水与NaOH混合,使一水合氨电离平衡逆向移动,氨气逸出.
解答 解:A.Fe与稀硫酸反应生成氢气,将装置中空气排出,关闭止水夹,利用氢气将硫酸亚铁压入含NaOH的试管中反应生成氢氧化亚铁,则图中装置可制备并观察氢氧化亚铁,故A正确;
B.过氧化钠与水反应生成氧气,且放热,脱脂棉燃烧,则图中装置可证明过氧化钠与水反应放热,故B正确;
C.Cu与浓硝酸反应生成二氧化氮,二氧化氮与水反应,不能利用排水法收集,故C错误;
D.浓氨水与NaOH混合,使一水合氨电离平衡逆向移动,氨气逸出,则图中装置可制备氨气,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的制备、性质实验、装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
7.物质的检验、鉴别要特别注意到共存物质的干扰,否则得到的结论就是不可靠的,例如,实验室用乙醇、浓硫酸在170℃时制得的CH2=CH2 中混有SO2,用溴水或酸性KMnO4溶液检验生成的CH2=CH2时,就要考 虑到SO2 的影响,因为SO2也能使溴水或酸性KMnO4溶液褪色,所以检验有CH2=CH2生成就需先除去SO2.下列实验设计所得结论可靠的是( )
| A. | 将电石与水反应产生的气体通入酸性KMnO4溶液中,溶液褪色说明有乙炔生成 | |
| B. | 将溴乙烷与NaOH 的乙醇溶液共热产生的气体通入到酸性KMnO4溶液中,溶液褪色说明有CH2=CH2生成 | |
| C. | 将溴乙烷与NaOH 的乙醇溶液共热产生的气体通入到溴水中,溴水褪色,说明有乙烯生成 | |
| D. | 将苯、液溴、铁粉混合物反应产生的气体通入到AgNO3溶液中有淡黄色沉淀产生,说明有HBr 生成 |
4.天津港“8.12”特大火灾爆炸事故,造成了极其恶劣的社会影响.原因是化学危险品随意堆放,管理人员安全意识淡漠,对人民的生命财产极不负责任.
下面是其中一部分危险品.请回答下列问题:
(1)写出过氧化氢的电子式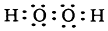
(2)上述危险品中,和水反应且符合下列条件的离子方程式2Na2O2+2H2O=4Na++4OH-+O2
①属于氧化还原反应 ②水既不做氧化剂也不做还原剂
(3)400℃时,硝酸铵会发生爆炸,生成氮气、二氧化氮和水蒸气,20g硝酸铵爆炸放出QkJ的热量,试写出该反应的热化学方程式4NH4NO3=3N2↑+2NO2↑+8H2O△H=-16QkJ/mol
(4)写出酸性高锰酸钾溶液与过氧化氢化应的离子方程式2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O
(5)氰化钠有剧毒,为防止扩散,消防队员和工作人员离场前都用双氧水消毒.氰化钠和双氧水反应生成一种酸式盐和一种有刺激性气味的气体,反应的离子方程式是CN-+H2O2+H2O═HCO3-+NH3↑
调查查明现场有700吨的氰化钠,如果用密度为1.2g/mL质量分数为17%的双氧水进行消毒,最少需要这种双氧水2.38×106L.
下面是其中一部分危险品.请回答下列问题:
硝酸铵 | 过氧化钠 高锰酸钾 氯酸钾 |
钠 钙 过氧化氢 | 氧化钠 |
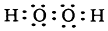
(2)上述危险品中,和水反应且符合下列条件的离子方程式2Na2O2+2H2O=4Na++4OH-+O2
①属于氧化还原反应 ②水既不做氧化剂也不做还原剂
(3)400℃时,硝酸铵会发生爆炸,生成氮气、二氧化氮和水蒸气,20g硝酸铵爆炸放出QkJ的热量,试写出该反应的热化学方程式4NH4NO3=3N2↑+2NO2↑+8H2O△H=-16QkJ/mol
(4)写出酸性高锰酸钾溶液与过氧化氢化应的离子方程式2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O
(5)氰化钠有剧毒,为防止扩散,消防队员和工作人员离场前都用双氧水消毒.氰化钠和双氧水反应生成一种酸式盐和一种有刺激性气味的气体,反应的离子方程式是CN-+H2O2+H2O═HCO3-+NH3↑
调查查明现场有700吨的氰化钠,如果用密度为1.2g/mL质量分数为17%的双氧水进行消毒,最少需要这种双氧水2.38×106L.
11.如图所示,甲池的总反应式为:CH4+2O2+2KOU=K2CO3+3H2O,下列说法正确的是( )


| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 | |
| B. | 甲池中正极的电极反应式是O2+4e-+4H+=2H2O | |
| C. | 反应过程中,乙池的pH逐渐减小 | |
| D. | 甲池中消耗O2的体积与丙池生成气体的总体积在相同条件下的比值为1:2 |
8.有a、b、c、d四个金属电极,G为电流计,有关的反应装置及部分反应现象记录如下:
由此可判断这四种金属的活动性顺序是( )
| 实验 装置 |  |  |  |  |
| 部分实 验现象 | a极质量减小 b极质量增加 | 溶液中的SO42--向b极移动 | d极溶解c极 有气体产生 | 电子从d极 流向a极 |
| A. | d>a>b>c | B. | a>b>c>d | C. | b>c>d>a | D. | a>b>d>c |
5.只用试管和胶头滴管而不用其他试剂无法鉴别的溶液是( )
| A. | AlCl3溶液和NaOH溶液 | B. | Na2CO3溶液和盐酸 | ||
| C. | NaAlO2溶液和盐酸 | D. | Al2(SO4)3溶液和氨水 |
6.用0.100mol/L标准盐酸溶液滴定20mL未知浓度的氢氧化钠溶液,下列操作会造成测定结果偏低的是( )
| A. | 装盐酸的滴定管用蒸馏水洗干净后立即装入盐酸 | |
| B. | 滴加盐酸时滴到锥形瓶外 | |
| C. | 滴定达到终点时,振荡时待测液溅出锥形瓶 | |
| D. | 滴定前装盐酸的滴定管有气泡,滴定后气泡消失 |
 本月4日,谷歌公司宣布:以60胜O负1平的战绩横扫众多围棋高手的神秘棋手“Master”乃是其人工智能产品AlpbaGo的升级版,人工智能再次成为热门话题.其中,高纯度硅是一种重要的基础材料.以下是工业上制取纯硅的一种方法:
本月4日,谷歌公司宣布:以60胜O负1平的战绩横扫众多围棋高手的神秘棋手“Master”乃是其人工智能产品AlpbaGo的升级版,人工智能再次成为热门话题.其中,高纯度硅是一种重要的基础材料.以下是工业上制取纯硅的一种方法: