题目内容
19.已知:氯化银、溴化银、硫化银的Ksp分别为1.56×10-10、7.7×10-13、6.3×10-50,某溶液中含有浓度均为 0.01mol/L 的Cl-、Br-、S2-,向该溶液中逐滴滴加0.01mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序是( )| A. | Cl-、Br-、S2- | B. | Br-、Cl-、S2- | C. | S2-、Br-、Cl- | D. | Br-、S2-、Cl- |
分析 溶液中含有浓度均为 0.01mol/L 的Cl-、Br-、S2-,结合Ksp计算需要的银离子浓度,c(Ag+)越小,阴离子先沉淀,以此来解答.
解答 解:生成AgCl时c(Ag+)=$\frac{1.56×1{0}^{-10}}{0.01}$=1.56×10-8mol/L,
生成AgBr时c(Ag+)=$\frac{7.7×1{0}^{-13}}{0.01}$=7.7×10-11mol/L,
生成硫化银时c(Ag+)=$\sqrt{\frac{6.3×1{0}^{-50}}{0.01}}$=2.5×10-24mol/L,
种阴离子产生沉淀的先后顺序是S2-、Br-、Cl-,
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的计算及银离子的浓度比较为解答的关键,侧重分析与计算能力的考查,注意Ksp的应用,题目难度不大.

练习册系列答案
相关题目
9.反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O中,还原产物是( )
| A. | CuSO4 | B. | H2SO4 | C. | H2O | D. | SO2 |
10.在含有FeCl3、FeCl2、AlCl3、NaCl的混合溶液中,加入足量的Na2O2固体,搅拌充分反应后,再加入过量盐酸,溶液中离子数目变化最小的是( )
| A. | Na+ | B. | Al3+ | C. | Fe2+ | D. | Fe3+ |
7.物质的检验、鉴别要特别注意到共存物质的干扰,否则得到的结论就是不可靠的,例如,实验室用乙醇、浓硫酸在170℃时制得的CH2=CH2 中混有SO2,用溴水或酸性KMnO4溶液检验生成的CH2=CH2时,就要考 虑到SO2 的影响,因为SO2也能使溴水或酸性KMnO4溶液褪色,所以检验有CH2=CH2生成就需先除去SO2.下列实验设计所得结论可靠的是( )
| A. | 将电石与水反应产生的气体通入酸性KMnO4溶液中,溶液褪色说明有乙炔生成 | |
| B. | 将溴乙烷与NaOH 的乙醇溶液共热产生的气体通入到酸性KMnO4溶液中,溶液褪色说明有CH2=CH2生成 | |
| C. | 将溴乙烷与NaOH 的乙醇溶液共热产生的气体通入到溴水中,溴水褪色,说明有乙烯生成 | |
| D. | 将苯、液溴、铁粉混合物反应产生的气体通入到AgNO3溶液中有淡黄色沉淀产生,说明有HBr 生成 |
14.下列两个热化学方程式中,△H1 和△H2的相对大小正确的是( )
S(s)+O2(g)=SO2(g)△H1; S(g)+O2(g)=SO2(g)△H2.
S(s)+O2(g)=SO2(g)△H1; S(g)+O2(g)=SO2(g)△H2.
| A. | △H1>△H2 | B. | △H1<△H2 | C. | △H1﹦△H2 | D. | 无法确定 |
4.天津港“8.12”特大火灾爆炸事故,造成了极其恶劣的社会影响.原因是化学危险品随意堆放,管理人员安全意识淡漠,对人民的生命财产极不负责任.
下面是其中一部分危险品.请回答下列问题:
(1)写出过氧化氢的电子式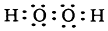
(2)上述危险品中,和水反应且符合下列条件的离子方程式2Na2O2+2H2O=4Na++4OH-+O2
①属于氧化还原反应 ②水既不做氧化剂也不做还原剂
(3)400℃时,硝酸铵会发生爆炸,生成氮气、二氧化氮和水蒸气,20g硝酸铵爆炸放出QkJ的热量,试写出该反应的热化学方程式4NH4NO3=3N2↑+2NO2↑+8H2O△H=-16QkJ/mol
(4)写出酸性高锰酸钾溶液与过氧化氢化应的离子方程式2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O
(5)氰化钠有剧毒,为防止扩散,消防队员和工作人员离场前都用双氧水消毒.氰化钠和双氧水反应生成一种酸式盐和一种有刺激性气味的气体,反应的离子方程式是CN-+H2O2+H2O═HCO3-+NH3↑
调查查明现场有700吨的氰化钠,如果用密度为1.2g/mL质量分数为17%的双氧水进行消毒,最少需要这种双氧水2.38×106L.
下面是其中一部分危险品.请回答下列问题:
硝酸铵 | 过氧化钠 高锰酸钾 氯酸钾 |
钠 钙 过氧化氢 | 氧化钠 |
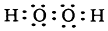
(2)上述危险品中,和水反应且符合下列条件的离子方程式2Na2O2+2H2O=4Na++4OH-+O2
①属于氧化还原反应 ②水既不做氧化剂也不做还原剂
(3)400℃时,硝酸铵会发生爆炸,生成氮气、二氧化氮和水蒸气,20g硝酸铵爆炸放出QkJ的热量,试写出该反应的热化学方程式4NH4NO3=3N2↑+2NO2↑+8H2O△H=-16QkJ/mol
(4)写出酸性高锰酸钾溶液与过氧化氢化应的离子方程式2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O
(5)氰化钠有剧毒,为防止扩散,消防队员和工作人员离场前都用双氧水消毒.氰化钠和双氧水反应生成一种酸式盐和一种有刺激性气味的气体,反应的离子方程式是CN-+H2O2+H2O═HCO3-+NH3↑
调查查明现场有700吨的氰化钠,如果用密度为1.2g/mL质量分数为17%的双氧水进行消毒,最少需要这种双氧水2.38×106L.
11.如图所示,甲池的总反应式为:CH4+2O2+2KOU=K2CO3+3H2O,下列说法正确的是( )


| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 | |
| B. | 甲池中正极的电极反应式是O2+4e-+4H+=2H2O | |
| C. | 反应过程中,乙池的pH逐渐减小 | |
| D. | 甲池中消耗O2的体积与丙池生成气体的总体积在相同条件下的比值为1:2 |
8.有a、b、c、d四个金属电极,G为电流计,有关的反应装置及部分反应现象记录如下:
由此可判断这四种金属的活动性顺序是( )
| 实验 装置 |  |  |  |  |
| 部分实 验现象 | a极质量减小 b极质量增加 | 溶液中的SO42--向b极移动 | d极溶解c极 有气体产生 | 电子从d极 流向a极 |
| A. | d>a>b>c | B. | a>b>c>d | C. | b>c>d>a | D. | a>b>d>c |