题目内容
3.泡沫灭火器内装的药液之一是NaHCO3饱和溶液,而不选用更廉价的Na2CO3饱和溶液,其原因是( )①质量相同的两种钠盐,NaHCO3与足量的酸反应产生的CO2比Na2CO3多 ②质量相同的两种钠盐,与足量酸反应产生相同体积(同温、同压下)的CO2 ③NaHCO3与酸反应生成CO2比Na2CO3快得多 ④NaHCO3比Na2CO3稳定,便于长期保存.
| A. | ①③ | B. | ②③ | C. | ①②③ | D. | ①②③④ |
分析 NaHCO3不稳定,加热易分解,NaHCO3和Na2CO3与酸发生反应时,分别发生Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaHCO3+HCl═NaCl+H2O+CO2↑,结合反应的方程式判断.
解答 解:NaHCO3和Na2CO3与酸发生反应时,分别发生Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaHCO3+HCl═NaCl+H2O+CO2↑,
①M(NaHCO3)<M(Na2CO3),质量相同的两种钠盐,NaHCO3物质的量较多,则与足量酸反应产生的CO2比Na2CO3多,故正确;
②由质量相同的两种钠盐,碳酸氢钠中含碳量高,生成的二氧化碳多,故错误;
③分别滴加HCl溶液,反应离子方程式为CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故正确;
④NaHCO3不稳定,加热易分解,故错误.
故选A.
点评 本题考查碳酸钠和碳酸氢钠的性质比较,是基础性试题的考查,试题注重基础,侧重能力的培养和训练,该题的关键是熟练掌握二者的化学性质,然后具体问题、具体分析即可,难度不大.

练习册系列答案
相关题目
14.下列两个热化学方程式中,△H1 和△H2的相对大小正确的是( )
S(s)+O2(g)=SO2(g)△H1; S(g)+O2(g)=SO2(g)△H2.
S(s)+O2(g)=SO2(g)△H1; S(g)+O2(g)=SO2(g)△H2.
| A. | △H1>△H2 | B. | △H1<△H2 | C. | △H1﹦△H2 | D. | 无法确定 |
11.如图所示,甲池的总反应式为:CH4+2O2+2KOU=K2CO3+3H2O,下列说法正确的是( )


| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 | |
| B. | 甲池中正极的电极反应式是O2+4e-+4H+=2H2O | |
| C. | 反应过程中,乙池的pH逐渐减小 | |
| D. | 甲池中消耗O2的体积与丙池生成气体的总体积在相同条件下的比值为1:2 |
8.有a、b、c、d四个金属电极,G为电流计,有关的反应装置及部分反应现象记录如下:
由此可判断这四种金属的活动性顺序是( )
| 实验 装置 |  |  |  |  |
| 部分实 验现象 | a极质量减小 b极质量增加 | 溶液中的SO42--向b极移动 | d极溶解c极 有气体产生 | 电子从d极 流向a极 |
| A. | d>a>b>c | B. | a>b>c>d | C. | b>c>d>a | D. | a>b>d>c |
15.下列变化中,属于还原反应的是( )
| A. | H+→H2O | B. | SO3→H2SO4 | C. | Fe2+→Fe3+ | D. | Cl2→Cl- |
5.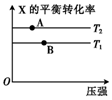 向某密闭容器中充入1mol X与2mol Y发生反应:X(g)+2Y(g)?aZ(g)△H<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示.下列说法中正确的是( )
向某密闭容器中充入1mol X与2mol Y发生反应:X(g)+2Y(g)?aZ(g)△H<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示.下列说法中正确的是( )
 向某密闭容器中充入1mol X与2mol Y发生反应:X(g)+2Y(g)?aZ(g)△H<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示.下列说法中正确的是( )
向某密闭容器中充入1mol X与2mol Y发生反应:X(g)+2Y(g)?aZ(g)△H<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示.下列说法中正确的是( )| A. | a=2 | B. | T2>T1 | ||
| C. | A点的反应速率:3v正(X)=v逆(Z) | D. | 表示A、B两点的反应速率:v(A)>v(B) |