题目内容
10.已知:Ag2SO4微溶于水,可溶于硝酸.溶液X中可能含有Na+、Ca2+、Fe2+、Cl-、Br-、CO32-、SiO32-、SO42-中的几种离子.为了确定其组成,某同学进行了如图实验:下列说法正确的是( )
| A. | 溶液X中一定含有Na+、Cl-和SiO32- | |
| B. | 溶液X中一定不含Ca2+、Br- | |
| C. | 为确定溶液X中是否含有SO42-,可取溶液2,加入BaCl2溶液 | |
| D. | 在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色 |
分析 溶液X与盐酸反应生成气体和沉淀,气体为二氧化碳、沉淀为硅酸,则一定含CO32-、SiO32-,由离子共存可知,一定不含Ca2+、Fe2+,由电荷守恒可知一定存在的阳离子为Na+;
溶液1与过量硝酸银反应生成白色沉淀应为AgCl或硫酸银,加盐酸引入氯离子,则不能确定是否含Cl-,且一定不含Br-,不能确定是否含SO42-,以此来解答.
解答 解:A.溶液X中一定含有Na+、CO32-、SiO32-,不能确定是否含Cl-,故A不选;
B.由上述分析可知,溶液X中一定不含Ca2+、Br-,故B选;
C.为确定溶液X中是否含有SO42-,可取溶液1,加入BaCl2溶液,因溶液2中含银离子,故C不选;
D.X中不含Fe2+,滴入盐酸、双氧水和硫氰化钾溶液后,溶液为无色,故D不选;
故选B.
点评 本题考查常见离子的检验,为高频考点,把握离子之间的反应、离子共存及电荷守恒为解答的关键,侧重分析与实验能力的考查,注意电荷守恒的应用,题目难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
8.有a、b、c、d四个金属电极,G为电流计,有关的反应装置及部分反应现象记录如下:
由此可判断这四种金属的活动性顺序是( )
| 实验 装置 |  |  |  |  |
| 部分实 验现象 | a极质量减小 b极质量增加 | 溶液中的SO42--向b极移动 | d极溶解c极 有气体产生 | 电子从d极 流向a极 |
| A. | d>a>b>c | B. | a>b>c>d | C. | b>c>d>a | D. | a>b>d>c |
6.用0.100mol/L标准盐酸溶液滴定20mL未知浓度的氢氧化钠溶液,下列操作会造成测定结果偏低的是( )
| A. | 装盐酸的滴定管用蒸馏水洗干净后立即装入盐酸 | |
| B. | 滴加盐酸时滴到锥形瓶外 | |
| C. | 滴定达到终点时,振荡时待测液溅出锥形瓶 | |
| D. | 滴定前装盐酸的滴定管有气泡,滴定后气泡消失 |
5.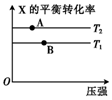 向某密闭容器中充入1mol X与2mol Y发生反应:X(g)+2Y(g)?aZ(g)△H<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示.下列说法中正确的是( )
向某密闭容器中充入1mol X与2mol Y发生反应:X(g)+2Y(g)?aZ(g)△H<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示.下列说法中正确的是( )
 向某密闭容器中充入1mol X与2mol Y发生反应:X(g)+2Y(g)?aZ(g)△H<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示.下列说法中正确的是( )
向某密闭容器中充入1mol X与2mol Y发生反应:X(g)+2Y(g)?aZ(g)△H<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示.下列说法中正确的是( )| A. | a=2 | B. | T2>T1 | ||
| C. | A点的反应速率:3v正(X)=v逆(Z) | D. | 表示A、B两点的反应速率:v(A)>v(B) |
15.在一定温度下的密闭容器中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),加入1molCO和1molH2O,达到平衡时测得n(H2)为0.5mol,下列说法不正确的是( )
| A. | 在该温度下平衡常数K=1 | |
| B. | 平衡时通入CO气体,则再次达平衡时,H2O的转化率增大.而CO的转化率减小 | |
| C. | 平衡时CO的体积分数为25% | |
| D. | 平衡常数与反应温度无关 |
2.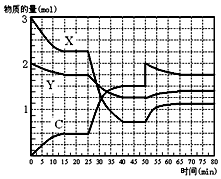 如图表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.下表是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
如图表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.下表是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
①X、Y、C三种气体发生反应的化学方程式为Y+3X?2C.
②表中a的取值范围是25.1<a<64.2.
③根据上图和上表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强.
 如图表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.下表是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
如图表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.下表是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).| 压强/Mpa C% 温度/℃ | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.5 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
②表中a的取值范围是25.1<a<64.2.
③根据上图和上表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强.
19.下列反应中,反应后固体物质增重的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 将Na2O2投入水中 | D. | 将锌粒投入Cu(NO3)2溶液 |
20.下列设计的实验方案能达到相应实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3 mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 检验Na2SO3晶体是否已氧化变质 | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 |
| D | 证明同温度下氯化银的溶解度大于硫化银的溶解度 | 向2 mL0.1 mol•L-1硝酸银溶液中加入1mL0.1mol•L-1 NaC1溶液,出现白色沉淀,再加入几滴0.1 mol•L-1的Na2S溶液,有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |