题目内容
9. 氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )| A. | 图中所示电极中,X端为负极,Y端为正极 | |
| B. | Y参与的电极反应为H2+2e-=2H+ | |
| C. | 反应过程中左边区域溶液pH逐渐升高 | |
| D. | 当有3gH+通过质子交换膜时,Z的体积为11.2L(标况) |
分析 根据氢离子移动方向可知,X端为阴极,Y端为阳极,则通入H2的一极为化合价升高,发生氧化反应,该极为阳极Y端;合成氨的阴极X端上氮气得到电子生成氨气,据此分析解答.
解答 解:A、根据氢离子移动方向可知,X端为阴极,Y端为阳极,故A错误;
B、Y端为阳极,H2失电子发生氧化反应,电极反应为H2-2e-=2H+,故B错误;
C、反应过程中左边X端为阴极,氮气得到电子结合氢离子生成氨气,所以pH逐渐升高,故C正确;
D、当有3g即3molH+通过质子交换膜时,则生成1mol氨气即Z的体积在标况下为22.4L,故D错误;
故选C.
点评 本题考查学生电解池的工作原理,难度中等,掌握电极反应是解题关键.

练习册系列答案
相关题目
19.向含有一定物质的量的FeCl3的溶液中逐渐加入铁粉,当溶液中的Fe3+与Fe2+的物质的量相等时,被还原的Fe3+的物质的量占到原Fe3+总物质的量的比例是( )
| A. | 50% | B. | 40% | C. | 60% | D. | 30% |
20.一般情况下,胶体粒子不易聚集,表现较稳定,主要原因是因为( )
| A. | 胶体有丁达尔效应 | |
| B. | B、胶体粒子直径在1nm-100nm之间 | |
| C. | 胶体粒子很小,不受重力作用 | |
| D. | 同种胶体粒子带同种电荷,它们之间互相排斥 |
17.《化学反应原理》选修模块从不同的视角对化学反应进行了探究分析.以下观点正确的是( )
| A. | 化学反应的反应热与反应的途径有关 | |
| B. | 电解过程中,化学能转化为电能而“储存”起来 | |
| C. | 强电解质溶液的导电能力一定强于弱电解质溶液 | |
| D. | 化学平衡常数的表达式与化学反应方程式的书写有关 |
4.可逆反应A(s)+B(g)?2C(g)△H<0在密闭容器中达到平衡后,改变条件,能使B转化率提高的是( )
| A. | 保持温度不变,减小压强 | B. | 保持恒温恒容,充入氦气 | ||
| C. | 其它条件不变时,升高温度 | D. | 其它条件不变时,加入少量A |
14.类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中正确的是( )
| A. | NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr | |
| B. | Fe与Cl2反应生成FeCl2,推测Fe与I2反应生成FeI3 | |
| C. | 不能电解AlCl3溶液来制取金属铝:推测也不能用电解MgCl2溶液来制取金属镁 | |
| D. | CO2与Na2O2反应只生成Na2O3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 |
1.下列关于胶体的说法不正确的是( )
| A. | 直径为1.3×10-9m 的“钴酞菁”分子分散在水中能形成胶体,则该分子的直径比Na+大 | |
| B. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| C. | 丁达尔现象可以用来区别胶体和溶液 | |
| D. | 明矾净水利用了胶体的性质 |
18.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图1:
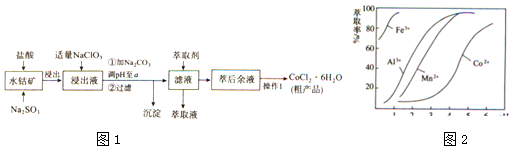
已知:
①浸出液含有的阳离子主要有H+、CO2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表(金属离子浓度为0.01mol/L):
③CoCI2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式:ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)惰性电极电解CoCl2溶液的阳极电极反应式为2Cl--2e-=Cl2↑.(注:横坐标依次为1-6;单位PH)
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图向“滤液”中加入萃取剂的目的是除去锰离子,其使用的最佳pH范围是B.
A. 2.0~2.5B. 3.0~3.5C. 4.0~4.5D. 5.0~5.5
(6)力测定粗产品中CoCl2•H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:
①浸出液含有的阳离子主要有H+、CO2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表(金属离子浓度为0.01mol/L):
| 淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式:ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)惰性电极电解CoCl2溶液的阳极电极反应式为2Cl--2e-=Cl2↑.(注:横坐标依次为1-6;单位PH)
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图向“滤液”中加入萃取剂的目的是除去锰离子,其使用的最佳pH范围是B.
A. 2.0~2.5B. 3.0~3.5C. 4.0~4.5D. 5.0~5.5
(6)力测定粗产品中CoCl2•H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
19.下列对物质的用途描述中错误的是( )
| A. | 明矾可以消毒杀菌常用于净水 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性 | |
| C. | 氢氧化铝在医疗上是治疗胃酸过多的一种药剂 | |
| D. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |