题目内容
4.可逆反应A(s)+B(g)?2C(g)△H<0在密闭容器中达到平衡后,改变条件,能使B转化率提高的是( )| A. | 保持温度不变,减小压强 | B. | 保持恒温恒容,充入氦气 | ||
| C. | 其它条件不变时,升高温度 | D. | 其它条件不变时,加入少量A |
分析 能使B转化率提高,应使平衡正向移动,且不能加入B,以此来解答.
解答 解:A.该反应为气体体积增大的反应,减小压强,平衡正向移动,B的转化率提高,故A选;
B.保持恒温恒容,充入氦气,平衡不移动,转化率不变,故B不选;
C.该反应为放热反应,升高温度,平衡逆向移动,转化率减小,故C不选;
D.A为固体,加少量A,平衡不移动,故D不选;
故选A.
点评 本题考查化学平衡移动,为高频考点,把握温度、压强对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意反应的特点,题目难度不大.

练习册系列答案
相关题目
14.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为2NA | |
| B. | 在反应KClO3+6HCl═KCl+3Cl2+3H2O中,每生成3molCl2转移的电子数为6NA | |
| C. | 含4molSi-O键的二氧化硅晶体中,氧原子数为2NA | |
| D. | 某密闭容器中盛有0.2molSO2和0.1molO2,在一定条件下充分反应,生成SO3分子数为0.2NA |
15.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使紫色石蕊试剂变红的溶液中:NO3-、I-、Ba2+、Fe2+ | |
| B. | 含有大量Fe3+的溶液中:SCN-、I-、K+、Br- | |
| C. | pH=1的溶液中:K+、Br-、SO42-、Al3+ | |
| D. | 澄清石灰水中:Na+、K+、CH3COO-、HCO3- |
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 mol?L-1 A1C13溶液中含有的Al3+数目小于NA | |
| B. | 标准状况下,11 g3H216O中含有的质子数目为6NA | |
| C. | 1 mol Li2O和Na2O2的混合物中含有的离子总数大于3NA | |
| D. | 常温常压下,4.6 g NO2所含的氮原子数目为0.1NA |
19.下列说法正确的是( )
| A. | 酸雨有很大的危害,应提倡工厂使用清洁能源,减少CO2的排放 | |
| B. | 木材浸过水玻璃后,具有良好的防火性能 | |
| C. | 烧碱和纯碱都属于碱 | |
| D. | 氯气泄漏后,人应逆风且往低处跑 |
9. 氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
 氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )| A. | 图中所示电极中,X端为负极,Y端为正极 | |
| B. | Y参与的电极反应为H2+2e-=2H+ | |
| C. | 反应过程中左边区域溶液pH逐渐升高 | |
| D. | 当有3gH+通过质子交换膜时,Z的体积为11.2L(标况) |
16.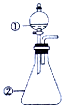 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠混合溶液 | 立即产生气泡 |
| B | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| C | 氯化铁溶液 | 淀粉碘化钾溶液 | 溶液变为蓝色 |
| D | 硫酸亚铁溶液 | 过氧化钠固体 | 产生气泡和白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
13.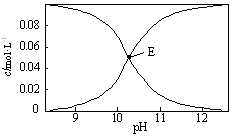 20℃时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol•L-1的混合溶液,溶液中c(HCO3-)、c(CO32-)与pH的关系如图所示.下列指定溶液中微粒的物质的量浓度关系正确的是( )
20℃时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol•L-1的混合溶液,溶液中c(HCO3-)、c(CO32-)与pH的关系如图所示.下列指定溶液中微粒的物质的量浓度关系正确的是( )
 20℃时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol•L-1的混合溶液,溶液中c(HCO3-)、c(CO32-)与pH的关系如图所示.下列指定溶液中微粒的物质的量浓度关系正确的是( )
20℃时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol•L-1的混合溶液,溶液中c(HCO3-)、c(CO32-)与pH的关系如图所示.下列指定溶液中微粒的物质的量浓度关系正确的是( )| A. | pH=9的溶液中:c(HCO3-)>c(H2CO3)>c(CO32-) | |
| B. | c(HCO3-)=c(CO32-)的E点溶液中:c(OH-)+c(CO32-)>c(H+)+c(H2CO3)+0.050 mol•L-1 | |
| C. | pH=11的溶液中:c(Na+)<2c(CO32-)+c(HCO3-) | |
| D. | 0.100 mol•L-1的Na2CO3溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) |