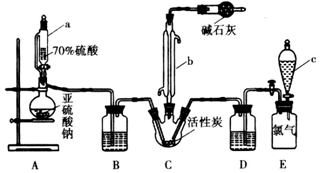
题目内容
19.下列对物质的用途描述中错误的是( )| A. | 明矾可以消毒杀菌常用于净水 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性 | |
| C. | 氢氧化铝在医疗上是治疗胃酸过多的一种药剂 | |
| D. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |
分析 A.明矾溶于水电离产生的铝离子水解生成具有吸附作用的氢氧化铝胶体;
B.依据次氯酸具有氧化性,具有杀菌消毒、漂白作用;
C.氢氧化铝能与盐酸反应,且碱性较弱;
D.钠性质活泼,具有较强的还原性.
解答 解:A.明矾溶于水电离产生的铝离子水解生成具有吸附作用的氢氧化铝胶体,可以净水,但是明矾不具有杀菌消毒作用,故A错误;
B.氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性,故B正确;
C.氢氧化铝能与盐酸反应,且碱性较弱,所以氢氧化铝可以用于治疗胃酸过多,故C正确;
D.钠性质活泼,具有较强的还原性,可用于冶炼金属钛、锆、铌等,故D正确;
故选:A.
点评 本题考查了元素化合物知识,侧重考查物质的用途,明确相关物质的性质及用途是解题关键,题目难度不大,有利于培养学生良好的科学素养,提高学习的积极性.

练习册系列答案
相关题目
9. 氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
 氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )| A. | 图中所示电极中,X端为负极,Y端为正极 | |
| B. | Y参与的电极反应为H2+2e-=2H+ | |
| C. | 反应过程中左边区域溶液pH逐渐升高 | |
| D. | 当有3gH+通过质子交换膜时,Z的体积为11.2L(标况) |
10.常温,下列溶液中各浓度关系不正确的是( )
| A. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,则一定有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) | |
| B. | 1L0.1mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 物质的量浓度分别为c1和c2的两种醋酸溶液,若其pH分别为a和a+1,则c1>10c2 |
4.铜粉放入稀硫酸溶液中,加热后无明显变化,但加入某盐一段时间后,发现铜粉质量减少,溶液呈蓝色,同时有气体逸出,该盐可能是( )
| A. | FeC13 | B. | Na2CO3 | C. | KNO3 | D. | FeSO4 |
6.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液实验如表所示:
由此判断:
(1)溶液中肯定存在的离子有:NO3-、SO42-、Mg2+、Al3+、Cl-,液中肯定不存在的离子有:I-、Ba2+、Fe2+、HCO3-,还需进一步实验才能确定是否存在K+. (填离子符号)
(2)请写出步骤b中溶液中所发生的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
| 实验步骤 | 实验现象 |
| a.取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| b.取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| c.取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| d.取少量该溶液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| e.取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子有:NO3-、SO42-、Mg2+、Al3+、Cl-,液中肯定不存在的离子有:I-、Ba2+、Fe2+、HCO3-,还需进一步实验才能确定是否存在K+. (填离子符号)
(2)请写出步骤b中溶液中所发生的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
3.下列说法正确的是( )
| A. | 苯和己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | C2H6和C9H20一定互为同系物 | |
| C. | 乙醇与乙酸在加热条件下、由稀硫酸催化可以生成乙酸乙酯 | |
| D. | 新戊烷和异丁烷的一氯代物均为一种 |