题目内容
14.如图是测量氧气含量的传感器工作示意图,利用氧气将AlI3氧化成I2,RbAg4I5是电解质,Ag作负极形成原电池,根据示数得出氧气含量.有关此电池说法正确的是( )
| A. | 电子由石墨电极流向银电极 | |
| B. | 多孔石墨电极上发生发生氧化反应 | |
| C. | 正极的电极反应式方程式为:2Ag++I2+2e -═2AgI | |
| D. | 当电池中有1 mol e一转移时消耗02的体积5.6 L |
分析 利用氧气将AlI3氧化成I2,RbAg4I5是电解质,Ag作负极形成原电池,可知在反应中Ag被氧化,为电池的负极反应,I2被还原,为原电池的正极,据此分析解答.
解答 解:A.电子由负极Ag电极流向正极石墨电极,故A错误;
B.石墨电极为正极,发生还原反应,故B错误;
C.原电池工作时,石墨电极为正极,I2被还原,反应式方程式为:2Ag++I2+2e -═2AgI,故C正确;
D.未指明标准状态,无法计算02的体积,故D错误.
故选C.
点评 本题考查原电池反应,题目难度不大,注意根据生成物判断原电池的正负极,为解答该题的关键,注意原电池的正负极的判断,把握电极反应式的书写.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.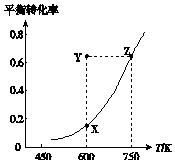 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )
 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )| A. | △H<0 | B. | 从Y点到Z点可通过升高温度实现 | ||
| C. | 从Y点到X点可通过使用催化剂实现 | D. | 600 K时,Y点甲醇的v正<v逆 |
5.下列图示与应叙述相符的是( )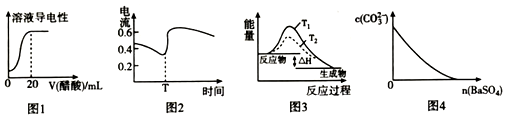

| A. | 图1表示向20mL0.lmol•L-l氯水中逐滴加入0.lmol•L-1醋酸,溶液导电性随加入酸体积的变化 | |
| B. | 图2表示酸性介质Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了 H2O2 | |
| C. | 图3表示S02与O2反应过程中的能量变化,其中T1>T2 | |
| D. | 图4表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c( CO32-)的浓度变化 |
2.下列除去有关物质中杂质(括号内的物质为杂质)的方案中,正确的是( )
| 选项 | 物质 | 除去杂质使用的试剂 | 除去杂质的方法 |
| A | CO2气体(HC1气) | 饱和Na2CO3溶液,浓硫酸 | 洗气 |
| B | NH4Cl固体(I2) | 加热 | |
| C | FeCl2溶液(FeCl3) | 氯水 | |
| D | MgCl2溶液(A1C13) | NaOH溶液,稀盐酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
19.已知反应M(g)+3N(g)?2Z(g)△H<0,在密闭容器中反应达到平衡时,N物质的量浓度为0.6mol/L.下列说法正确的是( )
| A. | N的正反应速率是M的逆反应速率的3倍 | |
| B. | 恒温恒容下,通入稀有气体使压强增大,平衡将正向移动 | |
| C. | 恒温下,扩大容器体积至原来的两倍,则N物质的量浓度大于0.6 mol/L | |
| D. | 恒温恒压下,增加Z的物质的量,重新达平衡时,N物质的量浓度大于0.6 mol/L |
6.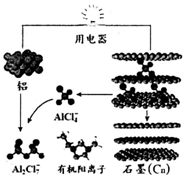 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,电子山石墨电极经用电器流向铝电极 | |
| B. | 充电时,铝电极上发生氧化反应 | |
| C. | 充电时,AlCI4-向铝电极方向移动 | |
| D. | 放电时,负极反应为:Al-3e-+7 AlCl4-═4A12C17- |
3.下列离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 铁粉溶于浓盐酸:Fe+2H+=Fe2++H2↑ | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| D. | 小苏打溶液中加入盐酸:CO32-+2H+=CO2↑+H2O |