题目内容
4.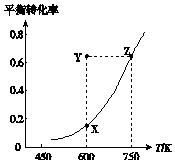 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )| A. | △H<0 | B. | 从Y点到Z点可通过升高温度实现 | ||
| C. | 从Y点到X点可通过使用催化剂实现 | D. | 600 K时,Y点甲醇的v正<v逆 |
分析 A、甲醇脱氢反应为吸热反应还是放热反应由温度对平衡移动的影响确定;
B、升高温度,平衡向正反应方向移动,甲醇转化率增大;
C、使用催化剂平衡不移动;
D、600K时Y点甲醇转化率大于X点甲醇平衡转化率.
解答 解:A、由图可知,温度越高甲醇平衡转化率越大,说明升高温度化学平衡正向移动,因此甲醇脱氢反应为吸热反应即△H>0,故A错误;
B、由图可知Y点和Z点甲醇转化率相等,升高温度,平衡向正反应方向移动,则甲醇转化率增大,所以从Y点到Z点不能通过升高温度实现,故B错误;
C、Y点和X点两点甲醇的平衡转化率不同,如果从Y点到X点平衡发生移动,所以不是使用催化剂,故C错误;
D、600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆),故D正确.
故选:D.
点评 本题考查化学平衡影响因素、焓变判断等,从图中提取有用信息的能力尤为关键,难度中等,注意基础知识理解掌握.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
13.同类晶体物质熔、沸点的变化是有规律的,试分析下列两组物质熔点规律变化的原因:
晶体熔、沸点的高低,决定于组成晶体微粒间的作用力的大小.A组是①离子晶体,晶体微粒之间通过②离子键相连,粒子之间的作用力由大到小的顺序是 ③NaCl>KCl>CsCl.B组晶体属于 ④金属晶体,价电子数由少到多的顺序是 ⑤Na<Mg<Al,离子半径由大到小的顺序是 ⑥Na+>Mg2+>Al3+.金属键强度由小到大的顺序为 ⑦Na<Mg<Al.
| A组物质 | 熔点/K | B组物质 | 熔点/K |
| NaCl | 1 074 | Na | 317 |
| KCl | 1 049 | Mg | 923 |
| CsCl | 918 | Al | 933 |
15.下列物质的电子式或结构式书写正确的是( )
| A. | 氯化铵的电子式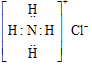 | B. | 氮气的电子式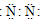 | ||
| C. | 次氯酸的结构式H-Cl-O | D. | 氯化钙的电子式 |
19.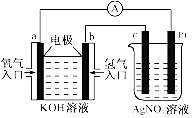 由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
 由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )| A. | 该装置中Pt极为阳极 | |
| B. | 当c极的质量变化了2.16g时,a极上消耗的O2在标准状况下的体积为1.12L | |
| C. | 该装置中b极的电极反应式是:H2+2OH--2e-=2H2O | |
| D. | 该装置中a极为正极,发生氧化反应 |
9.下列各组离子在指定溶液中能大量共存的是( )
| A. | 能使红色石蕊试纸变蓝的溶液中:Na+、K+、NO3-、AlO2- | |
| B. | 在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| C. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| D. | 能使湿润的淀粉碘化钾试纸变蓝的溶液中:Na+、NH4+、S2-、Br- |
13.下列实验方法不能达到实验目的是( )
| A. | 用丁达尔效应区分氢氧化铁胶体与氯化铜溶液 | |
| B. | 用澄清石灰水鉴别NaHCO3和Na2CO3 | |
| C. | 用分液法分离植物油和水的混合物 | |
| D. | 用淀粉溶液检验食盐溶液中是否存在I2 |
14.如图是测量氧气含量的传感器工作示意图,利用氧气将AlI3氧化成I2,RbAg4I5是电解质,Ag作负极形成原电池,根据示数得出氧气含量.有关此电池说法正确的是( )

| A. | 电子由石墨电极流向银电极 | |
| B. | 多孔石墨电极上发生发生氧化反应 | |
| C. | 正极的电极反应式方程式为:2Ag++I2+2e -═2AgI | |
| D. | 当电池中有1 mol e一转移时消耗02的体积5.6 L |



