题目内容
9.某化学小组在实验室中对SO2的性质进行探究.回答下列问题:(1)学生甲以Na2SO3粉末和浓H2SO4为原料制取SO2,装置A中仪器X的名称是长颈漏斗;现欲收集一瓶干燥的SO2,选择图1中的装置,其连接顺序为abcedf(或abcedbcf)(按气流方向,用小写字母表示).
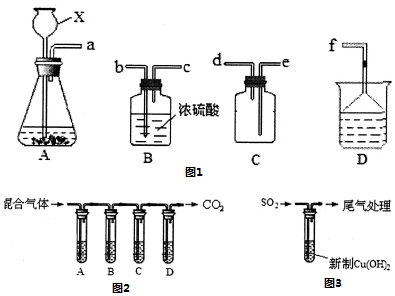
(2)学生乙用浓H2SO4和乙醇反应得到的乙烯气体中含有SO2、CO2.现选择图3中的装置,检验混合气体中存在乙烯和SO2,则装置中盛放的试剂是A品红溶液,BNaOH溶液,C品红溶液,D酸性高锰酸钾溶液.
(3)学生丙测得常温下SO2的饱和溶液的pH=a,用中和滴定法测得其物质的量浓度为c.该溶液中可认为c(H+)≈c(HSO3-),根据Kal=10-2a/(c-10-a)近似计算H2SO3的一级电离常数Ka1.该法测定的H2SO3的Ka1与理论值相差较大,判断Ka1实验值比理论值偏小(填“偏大”或“偏小”),理由是SO2饱和溶液中存在大量的水合SO2分子,使测定的c值比实际H2SO3的浓度偏大.
(4)学生丁选择图3装置将SO2通入新制的Cu(OH)2悬浊液中.
①实验I:新制的Cu(OH)2悬浊液由过量CuSO4溶液和NaOH溶液配制.现象:开始析出砖红色沉淀;一段时间后,砖红色沉淀消失;静置,生成少量紫红色固体,溶液变绿色.推测开始析出的砖红色沉淀是Cu2O;实验I证明SO2具有还原性.
②实验II:新制的Cu(OH)2悬浊液由过量CuCl2溶液和NaOH溶液配制.现象:开始析出黄色沉淀;一段时间后,黄色沉淀消失;静置,生成大量白色沉淀,溶液变绿色.经检验白色沉淀为CuCl,则由Cu(OH)2生成CuCl的离子方程式为:2Cu(OH)2+2Cl-+SO2=2CuCl↓+SO42-+2H2O.
推测实验I和实验II的现象差异与Cl-有关而与SO42-无关.请设计实验证明上述推测是否合理,简述操作、现象和有关结论先利用CuCl2溶液和NaOH溶液配制新制的Cu(OH)2悬浊液;过滤,用蒸馏水洗涤Cu(OH)2固体,并检验是否洗涤干净;向洗净的Cu(OH)2固体中加入适量蒸馏水振荡,然后持续通入SO2.若现象与实验Ⅰ相同,则证明上述推测合理,否则不合理.
分析 (1)根据常用仪器的名称及用途进行分析回答;收集一瓶干燥的SO2,则须先制取气体,然后干燥,再收集,因为二氧化硫有毒、易溶于水,还要对尾气进行吸收处理,为防止吸收尾气的水进入二氧化硫集气瓶,利用浓硫酸具有吸水性进行干燥;
(2)因二氧化碳对乙烯的检验无干扰,所以根据实验的目的是检验乙烯和二氧化硫,需要先检验乙烯中含有二氧化硫,然后除去杂质二氧化硫,再检验乙烯;
(3)二氧化硫和水反应为可逆反应,SO2饱和溶液中存在大量的水合SO2分子,使测定的c值比实际H2SO3的浓度偏大;
(4)①二氧化硫具有还原性,新制的氢氧化铜具有弱氧化性,砖红色沉淀是被还原的产物Cu2O;
②白色沉淀为CuCl,新制的氢氧化铜具有弱氧化性,氧化二氧化硫为硫酸根离子,根据得失电子守恒和电荷守恒书写离子方程式;综合实验I、实验II,推测实验I和实验II的现象差异与Cl-有关而与SO42-无关,不用含硫酸根离子的盐配制氢氧化铜,然后进行对照试验.
解答 解:(1)装置A中仪器X具有长颈球形特征,是长颈漏斗,现欲收集一瓶干燥的SO2,装置的导管按气流方向连接的顺序是:装置A制取二氧化硫,a通过导管b把二氧化硫导入试剂瓶中进行干燥,通过c 导管导出后,通过e导管导入集气瓶中收集,为了防止二氧化硫逸出扩散到空气中污染环境,应该把d导管连接到e导管上,为防止通过D吸收逸出的二氧化硫的水逸到C中,把d导管连接到b把二氧化硫导入试剂瓶中进行干燥,通过c 导管导出后,连接f;
故答案为:长颈漏斗;abcedf(或abcedbcf);
(2)检验二氧化硫用品红溶液,检验乙烯用酸性高锰酸钾溶液,乙烯和二氧化硫都能使酸性高锰酸钾溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除尽SO2,再通过品红溶液不褪色确认SO2已除干净,最后用酸性高锰酸钾溶液检验乙烯,因装置A用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置B试管装有NaOH溶液除去SO2,装置C试管通过品红溶液不褪色确认SO2已除干净,装置D通过酸性高锰酸钾溶液褪色检验乙烯,
故答案为:品红溶液;NaOH溶液; 品红溶液;酸性高锰酸钾溶液;
(3)二氧化硫和水反应SO2+H2O?H2SO3,因该反应为可逆反应,SO2饱和溶液中存在大量的水合SO2分子,该法测定的H2SO3的Ka1与理论值比较,使测定的c值比实际H2SO3的浓度偏大,Ka1实验值比理论值偏小,
故答案为:偏小;SO2饱和溶液中存在大量的水合SO2分子,使测定的c值比实际H2SO3的浓度偏大;
(4)①新制的Cu(OH)2悬浊液由过量CuSO4溶液和NaOH溶液配制,开始析出砖红色沉淀为Cu2O,Cu(OH)2中+2价的铜被还原成+1价的铜,说明二氧化硫具有还原性,
故答案为:Cu2O;还原性;
②实验II:新制的Cu(OH)2悬浊液由过量CuCl2溶液和NaOH溶液配制,析出白色沉淀为CuCl,新制的氢氧化铜氧化二氧化硫为硫酸根离子,根据得失电子守恒和电荷守恒,离子方程式为:2Cu(OH)2+2Cl-+SO2=2CuCl↓+SO42-+2H2O,综合实验I、实验II,推测实验I和实验II的现象差异与Cl-有关而与SO42-无关,先利用CuCl2溶液和NaOH溶液配制新制的Cu(OH)2悬浊液;过滤,用蒸馏水洗涤Cu(OH)2固体,并检验是否洗涤干净;向洗净的Cu(OH)2固体中加入适量蒸馏水振荡,然后持续通入SO2.若现象与实验Ⅰ相同,则证明上述推测合理,否则不合理,
故答案为:2Cu(OH)2+2Cl-+SO2=2CuCl↓+SO42-+2H2O;先利用CuCl2溶液和NaOH溶液配制新制的Cu(OH)2悬浊液;过滤,用蒸馏水洗涤Cu(OH)2固体,并检验是否洗涤干净;向洗净的Cu(OH)2固体中加入适量蒸馏水振荡,然后持续通入SO2.若现象与实验Ⅰ相同,则证明上述推测合理,否则不合理.
点评 本题考查了SO2的性质探究实验,涉及二氧化硫的还原性、漂白性、氧化还原反应原理、乙烯的性质、实验方案的设计等知识,注意当有多种产物需检验时,应考虑先后顺序,题目难度中等.

 阅读快车系列答案
阅读快车系列答案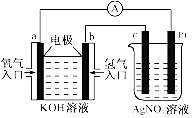 由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )| A. | 该装置中Pt极为阳极 | |
| B. | 当c极的质量变化了2.16g时,a极上消耗的O2在标准状况下的体积为1.12L | |
| C. | 该装置中b极的电极反应式是:H2+2OH--2e-=2H2O | |
| D. | 该装置中a极为正极,发生氧化反应 |
| A. | 探究H2O2溶液的氧化性:将H2O2溶液滴在淀粉碘化钾试纸上 | |
| B. | 验证醋酸是弱电解质:常温下测定0.1 mol•L-1CH3COONa溶液的pH | |
| C. | 比较铁与铜的还原性:常温下将铁片与铜片分别加入到浓HNO3中 | |
| D. | 检验溴元素:取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液 |
| A. | 将它们溶解,观察溶液颜色 | |
| B. | 分别放在炒锅中加热观察是否有残留固物 | |
| C. | 分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧观察火焰颜色 | |
| D. | 取相同质量的样品分别加入等体积的白醋观察反应的剧烈程度 |

| A. | CPMA的分子式为C17H18O4 | |
| B. | 1 mol CPMA中含有7 mol双键 | |
| C. | 1 mol CPMA最多可与2molNaOH反应 | |
| D. | CPMA能使酸性高锰酸钾溶液、溴水褪色 |

| A. | 电子由石墨电极流向银电极 | |
| B. | 多孔石墨电极上发生发生氧化反应 | |
| C. | 正极的电极反应式方程式为:2Ag++I2+2e -═2AgI | |
| D. | 当电池中有1 mol e一转移时消耗02的体积5.6 L |
| A. | “84”消毒液与“洁厕灵混合使用,去污效果更好” | |
| B. | 利用盐酸刻蚀石英制作艺术品 | |
| C. | 福尔马林可用于保存海鲜制品 | |
| D. | “地沟油”经过加工处理可用于制生物柴油 |
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球位于蒸馏烧瓶支管处,且冷凝水流向由下往上 | |
| C. | 蒸发操作是,待混合物的水分完全蒸干后,停止加热 | |
| D. | 向容量瓶中转移溶液时,用玻璃棒引流 |
| A. | 还原性:Ni>Cu | B. | 氧化性:Cu2+>Ag+ | C. | 还原性:Ag>Cu | D. | 氧化性:Ni2+>Ag+ |