题目内容
19.下列有关化学用语表示正确的是( )| A. | Mg原子的结构示意图: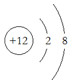 | B. | OCl2分子的电子式: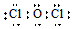 | ||
| C. | HF分子的电子式: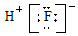 | D. | Na2S形成的电子式 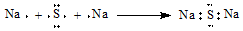 |
分析 A、镁原子的核外有12个电子;
B、OCl2分子中O原子的最外层有6个电子,而Cl原子的最外层有7个电子;
C、HF是由H原子和F原子形成的共价化合物;
D、硫化钠为离子化合物.
解答 解:A、,镁原子的核外有12个电子,即最外层有2个电子,故结构示意图为 ,故A错误;
,故A错误;
B、OCl2分子中O原子的最外层有6个电子,而Cl原子的最外层有7个电子,故两个Cl原子分别与O原子形成一对共用电子对,故电子式为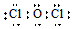 ,故B正确;
,故B正确;
C、HF是由H原子和F原子形成的共价化合物,即H原子和F原子之间以共价键结合,故氟化氢的电子式为 ,故C错误;
,故C错误;
D、硫化钠为离子化合物,一个钠原子失去一个电子,一个硫原子得到两个电子,则用电子式表示Na2S的形成过程为: .故D错误.
.故D错误.
故选B.
点评 本题考查了化学用语,掌握结构示意图、电子式以及用电子式表示物质的形成过程等书写规则是解题关键,难度不大,注意离子化合物和共价化合物电子式的书写区别.

练习册系列答案
相关题目
9.X、Y、Z、W是原子序数依次增大的不同主族短周期元素,其中两种为金属元素,X原子的最外层电子数与次外层电子数相等,X与W、Y与Z这两对原子的最外层电子数之和均为9.下列说法正确的是( )
| A. | Y、Z、W的简单离子半径Z>W>Y | B. | 工业上制取Y可用电解YW3制得 | ||
| C. | XW2中各原子均达到8电子结构 | D. | Z、W的氧化物对应水化物的酸性Z<W |
10.对于100mL1mol/L盐酸与铁片的反应,采取下列措施,其中不能使反应速率加快的是( )
| A. | 升高温度 | B. | 改用50mL2mol/L盐酸 | ||
| C. | 改用200mL1mol/L盐酸 | D. | 用等量铁粉代替铁片 |
7.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A. | 四种元素位于同一周期 | B. | 氢化物的稳定性:H2Y>HZ | ||
| C. | 原子序数a>b>d>c | D. | a+3=c-2 |
14.液化气的主要成分是丙烷,下列有关丙烷的叙述不正确的是( )
| A. | 是直链烃,但分子中3个碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比丁烷沸点高 | |
| D. | 1 mol丙烷完全燃烧消耗5 mol O2 |
4.金刚石和石墨是碳元素的两种结构不同的单质(同素异形体).在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能.试判断在100kPa时,下列结论正确的是( )
| A. | 金刚石比石墨稳定 | |
| B. | 1mol石墨比1mol金刚石的总能量高 | |
| C. | 若在等量氧气中充分燃烧,1mol金刚石比1mol石墨的释放的能量高 | |
| D. | 仅提供1.895 kJ的热能,工业上就能将1mol石墨转化为金刚石 |
11.下列反应的离子方程式正确的是( )
| A. | 用KIO3 氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向Ca(ClO)2溶液中通入过量CO2制次氯酸:ClO-+H2O+CO2═HClO+HCO3- | |
| C. | 向酸性KMnO 4溶液中滴入H 2O2:2MnO 4-+6H++3H2O2═2Mn 2++4O2↑+6H2O | |
| D. | 用Cl2与石灰乳反应制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O |
8.下列叙述中正确的是( )
| A. | 某ⅡA族元素的原子序数为a,则原子序数为a+1的元素一定是ⅢA族元素 | |
| B. | 除短周期外,其他周期均有32种元素 | |
| C. | 原子最外层只有2个电子的元素可能是金属元素也可能是非金属元素 | |
| D. | 碱金属元素是指ⅠA族的所有元素 |
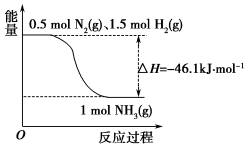 氨在工农业生产中应用广泛.
氨在工农业生产中应用广泛.