题目内容
已知5%氨水的密度为0.98g/cm,25%氨水的密度为0.91g/cm,若将上述两溶液等体积混合,所得氨水溶液的质量分数是( )
| A、等于15% | B、大于15% |
| C、小于15% | D、无法估计 |
考点:溶液中溶质的质量分数及相关计算
专题:
分析:本题可以看出,氨水浓度越大密度越小.等体积相混合时,浓度较稀的氨水质量较大,而较浓的氨水的质量较小,这样混合后,所得溶液浓度当然要比15%偏小些,或根据公式溶质质量分数=
×100%计算.
| 溶质质量 |
| 溶液质量 |
解答:
解:若两种氨水等质量混合,则混合后氨水的质量分数为15%,等体积的两种氨水,浓的密度较小,所以质量较小,两种氨水混合后,质量分数更接近稀氨水的浓度,所得氨水溶液的质量分数小于15%.
或直接计算:设25%的氨水和5%的氨水各取VL,则混合后的氨水的质量分数:
设这两种溶液的体积是V.则
×100%=14.6%<15%,
故选C.
或直接计算:设25%的氨水和5%的氨水各取VL,则混合后的氨水的质量分数:
设这两种溶液的体积是V.则
| 0.91V×25%+0.98V×5% |
| 0.91V+0.98V |
故选C.
点评:本题考查了有关溶质质量分数的简单计算.①密度比水大的两种不同浓度溶液混合,等体积混合后所得溶液中溶质的质量分数大于等质量混合后所得溶液中溶质的质量分数(即两种溶液中溶质的质量分数之和的一半).如氢氧化钠、氯化钠溶液等.同理有:②密度比水小的两种不同浓度溶液混合,等体积混合后所得溶液中溶质的质量分数小于等质量混合后所得溶液中溶质的质量分数(即两种溶液中溶质的质量分数之和的一半).如氨水、酒精溶液等.

练习册系列答案
相关题目
常温下,在20mL0.1mol?L-1Na2CO3溶液中逐渐滴入0.1mol?L-1HCl溶液40mL,溶液的PH逐渐降低,下列说法正确的是( )
| A、完全反应以后,溶液呈现中性 |
| B、当盐酸加入10mL时,溶液中:c(CO32-)=C(HCO3-) |
| C、在20mL0.1mol?L-1Na2CO3溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-) |
| D、当盐酸加入20mL时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
下列与化学反应能量变化相关的叙述正确的是( )
| A、对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在其他条件不变的情况下,改变压强,平衡不发生移动,反应放出的热量不变 |
| B、同温同压下,H2(g)+Cl2═2HCl(g)在光照和点燃条件下的焓变不同 |
| C、甲烷的标准燃烧热为-890.3KJ?mol-1,则甲烷的燃烧热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ?mol-1 |
| D、500℃,30MPa下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3气体,放热19.3KJ,其热化学方程式为:N2(g)+3H2?2NH3(g)△H=-38.6KJ?mol-1 |
下列类比关系正确的是( )
| A、Fe在冷的浓硝酸中发生钝化,Cu在冷的浓硝酸中也发生钝化 |
| B、Na2O2 与CO2反应生成Na2CO3和O2,与SO2反应可生成Na2SO3和O2 |
| C、Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 |
| D、Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应 |
已知25℃?101kPa下,石墨?金刚石燃烧的热化学方程式分别为:C(石墨,s)+O2(g)═CO2(g)△H=-393.51kJ/mol;C(金刚石,s)+O2(g)═CO2(g)△H=-395.41kJ/mol.据此判断,下列说法中正确的是( )
| A、由石墨制备金刚石是吸热反应;石墨的能量比金刚石的低 |
| B、由石墨制备金刚石是吸热反应;石墨的能量比金刚石的高 |
| C、由石墨制备金刚石是放热反应;石墨的能量比金刚石的低 |
| D、由石墨制备金刚石是放热反应;石墨的能量比金刚石的高 |
在物质分类中,前者包含后者的是( )
| A、氧化物、化合物 |
| B、固体、晶体 |
| C、溶液、胶体 |
| D、碱性氧化物、酸性氧化物 |
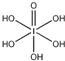 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6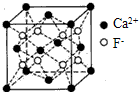 离子各一个)
离子各一个)