题目内容
卤族元素的单质和化合物很多.
(1)卤族元素位于周期表的 区;溴的价电子排布式为 .
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是 (3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 .
(4)已知高碘酸有两种形式,化学式分别为H5IO6(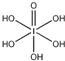 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6 HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6 HIO4.(填“>”、“<”或“=”)
(5)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 (填序号)式发生.A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(6)ClO2-中心原子的杂化类型为 ,写出ClO2-的两个等电子体(分子、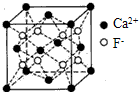 离子各一个) .
离子各一个) .
CaF2晶体晶胞
(7)已知CaF2晶体(如图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为 .
(1)卤族元素位于周期表的
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是
| 元素名称 | 氟 | 氯 | 溴 | 碘 | 砹 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6(5)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列
(6)ClO2-中心原子的杂化类型为
 离子各一个)
离子各一个)CaF2晶体晶胞
(7)已知CaF2晶体(如图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为
考点:氯、溴、碘及其化合物的综合应用,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构,卤族元素
分析:(1)根据基态原子核外电子排布式中最后填入电子名称确定区域名称,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子;
(2)F的非金属性很强,HF分子之间能形成氢键;
(3)元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子;
(4)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(5)离子晶体的晶格能与离子半径成反比,与离子所带电荷成正比;
(6)根据价层电子对互斥理论来确定其杂化方式,价层电子对个数=σ键个数+孤电子对个数;等电子体是具有相同的价电子数和相同原子数的微粒;
(7)利用均摊法确定该立方体中含有的离子,根据ρV=nM计算相对分子质量.
(2)F的非金属性很强,HF分子之间能形成氢键;
(3)元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子;
(4)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(5)离子晶体的晶格能与离子半径成反比,与离子所带电荷成正比;
(6)根据价层电子对互斥理论来确定其杂化方式,价层电子对个数=σ键个数+孤电子对个数;等电子体是具有相同的价电子数和相同原子数的微粒;
(7)利用均摊法确定该立方体中含有的离子,根据ρV=nM计算相对分子质量.
解答:
解:(1)根据构造原理知,卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的p区;溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,所以其价电子排布式为:4s24p5,故答案为:p;4s24p5;
(2)F的非金属性很强,HF分子之间能形成氢键,所以在二分子缔合(HF)2中使氢氟酸分子缔合的作用力是氢键;故答案为:氢键;
(3)卤族元素包含:F、Cl、Br、I、At元素,元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,从表中数据可知卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,故答案为:碘;
(4)H5IO6( )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,故答案为:<;
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,故答案为:<;
(5)离子晶体中离子电荷越多,半径越小离子键越强,离子晶体的晶格能越大,已知已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,所以发生的反应为CsICl2=CsCl+ICl,故答案为:A;
(6)ClO2-中心氯原子的价层电子对数n=2+
=4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,所以与ClO2-互为等电子体的为Cl2O、OF2、BrO2-等,故答案为:sp3;Cl2O、OF2、BrO2-;
(7)该晶胞中含有钙离子个数=6×
+8×
=4,含有氟离子个数=8,根据ρV=nM=
×M,所以:M=
ρVNA,则M=
a3ρNA
故答案为:
a3ρNA.
(2)F的非金属性很强,HF分子之间能形成氢键,所以在二分子缔合(HF)2中使氢氟酸分子缔合的作用力是氢键;故答案为:氢键;
(3)卤族元素包含:F、Cl、Br、I、At元素,元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,从表中数据可知卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,故答案为:碘;
(4)H5IO6(
 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,故答案为:<;
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,故答案为:<;(5)离子晶体中离子电荷越多,半径越小离子键越强,离子晶体的晶格能越大,已知已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,所以发生的反应为CsICl2=CsCl+ICl,故答案为:A;
(6)ClO2-中心氯原子的价层电子对数n=2+
| 7+1-2×2 |
| 2 |
(7)该晶胞中含有钙离子个数=6×
| 1 |
| 2 |
| 1 |
| 8 |
| 4 |
| NA |
| 1 |
| 4 |
| ||
| 2 |
故答案为:
| ||
| 2 |
点评:本题为综合题型,考查物质结构与性质,涉及元素周期表、价电子排布、晶格能、晶体结构与性质、杂化轨道、等电子体、晶胞计算等,难道在于有关晶胞结构的计算,掌握晶胞结构是解题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 以铬酸钾((K2CrO4))为原料,用电化学法制备铬酸钾(K2CrO4)的实验装置如图,其反应原理可表示为4Kr2CrO4+4H2O
以铬酸钾((K2CrO4))为原料,用电化学法制备铬酸钾(K2CrO4)的实验装置如图,其反应原理可表示为4Kr2CrO4+4H2O| 通电 |
| A、在阴极室,随着反应的进行溶液的pH逐渐变小 |
| B、不锈钢电极上生成O2,惰性电极上得到H2 |
| C、惰性电极发生的电极反应为2H2O-4e-═4H++O2↑ |
| D、不锈钢应连接直流电源的正极 |
用价层电子对互斥理论(VSEPR)可以预测许分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
| A、C02、CS2、SO2都是直线型的分子 |
| B、COCl2、SF6、CO32-都是平面三角型的分子 |
| C、BF3分子的键角大于CH4分子的键角 |
| D、PCl3、NH3、BCl3都是三角锥形的分子 |
下列说法正确的是( )
①铁元素位于元素周期表中第四周期第ⅧB族
②保存FeSO4溶液,为防止其变质,需向溶液中加入铁粉和稀硫酸
③工业上通过电解氯化镁溶液制取单质镁
④将SiO2和水加热可制得H2SiO3
⑤氯水久置之后,最终会变成稀盐酸
⑥向偏铝酸钠溶液中通入二氧化碳,产生白色沉淀,继续通入二氧化碳,沉淀不溶解.
①铁元素位于元素周期表中第四周期第ⅧB族
②保存FeSO4溶液,为防止其变质,需向溶液中加入铁粉和稀硫酸
③工业上通过电解氯化镁溶液制取单质镁
④将SiO2和水加热可制得H2SiO3
⑤氯水久置之后,最终会变成稀盐酸
⑥向偏铝酸钠溶液中通入二氧化碳,产生白色沉淀,继续通入二氧化碳,沉淀不溶解.
| A、①②⑥ | B、②③⑥ |
| C、②⑤⑥ | D、②④⑤ |
已知5%氨水的密度为0.98g/cm,25%氨水的密度为0.91g/cm,若将上述两溶液等体积混合,所得氨水溶液的质量分数是( )
| A、等于15% | B、大于15% |
| C、小于15% | D、无法估计 |
在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为ω,物质的量浓度为c mol?L-1.则下列选项不正确的是( )
A、溶质的质量分数为ω=
| ||
| B、用水稀释该溶液,OH- 的物质的量增加 | ||
| C、该溶液中共有6种微粒 | ||
| D、上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5ω |
下列叙述的两个量,一定相等的是( )
| A、0.1 mol?L-1 NaCl与0.05 mol?L-1 Na2CO3溶液中的Na+数目 |
| B、质量相等的金刚石与C60中的碳原子数目 |
| C、标准状况下,等体积的SO2与SO3的分子数目 |
| D、28 g乙烯气体和56g环丁烷(C4H8)气体中含有的碳原子数 |
 I.科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是
I.科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是